Bernard-Soulier-Syndrom
| Klassifikation nach ICD-10 | |
|---|---|
| D69.1 | Thrombozytopathie |
| ICD-10 online (WHO-Version 2019) | |
Das Bernard-Soulier-Syndrom (BSS), auch als Hämorrhagische Thrombozytendystrophie oder Riesen-Plättchen-Syndrom bezeichnet, ist eine sehr seltene autosomal-rezessiv vererbte Blutungskrankheit, die zu den Thrombozytopathien gerechnet wird.
Erstbeschreibung
Die Erkrankung wurde erstmals 1948 durch die beiden französischen Hämatologen Jean Bernard (1907–2006) und Jean-Pierre Soulier (1915–2003) beschrieben.[1] Die beiden beschrieben den Fall eines jungen männlichen Patienten mit Blutungsneigung, Thrombozytopenie und extrem vergrößerten Thrombozyten („Riesenthrombozyten“). Der Patient stellte sich im Alter von 15 Jahren wegen schweren Nasenblutens, sowie Blut im Stuhlgang vor, erlitt dann in den folgenden Jahren wiederholte Blutungen und verstarb im Alter von 28 Jahren an einer Hirnblutung. Seine Schwester starb schon im Kleinkindalter von 31 Monaten. Die Eltern und andere Geschwister waren nicht betroffen.
Ursache und Genetik

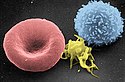
Von links nach rechts: Erythrozyt (rotes Blutkörperchen), normaler Thrombozyt (aktiviert) und Leukozyt
In den 1970er Jahren wurde entdeckt, dass Bernard-Soulier-Patienten bestimmte Proteine auf der Oberfläche ihrer Thrombozyten fehlen. Außerdem ließen sich ihre Thrombozyten nicht mit dem Peptidantibiotikum Ristocetin aggregieren, wie das bei normalen Thrombozyten der Fall ist.[2] Der Blutungsneigung lag also eine Funktionsstörung der Thrombozyten zugrunde, die ein Agglutinieren der Thrombozyten verhindert.
Ursache der Funktionsstörung ist ein Mangel oder eine Dysfunktion des Glykoprotein-Ib-V-IX-Komplexes (GPIb-V-IX). GPIb-V-IX wird nur von Thrombozyten exprimiert. Es ist ein aus mehreren Untereinheiten zusammengesetzter Rezeptor, der bei primären Hämostase (Blutgerinnung) zur Bindung des Von-Willebrand-Faktors (vWF, ein Trägerprotein) von entscheidender Bedeutung ist. Erst durch Bindung von vWF ist die Adhäsion der Thrombozyten an das verletzte Endothel, sowie die des Von-Willebrand-Faktors und das Agglutinieren auch unter hohen Scherkräften möglich.[3]
Der GPIb-V-IX-Komplex besteht aus vier Untereinheiten, die durch vier verschiedene Gene kodiert werden:[3]
- GPIb-Alpha durch Chromosom 17 Genlocus 17pter-p12
- GPIb-Beta durch Chromosom 22 Genlocus 22q11.2
- GPV durch Chromosom 3 Genlocus 3q29
- GPIX durch Chromosom 3 Genlocus 3q21
Mit Ausnahme des GPV-Gens wurden in allen Genen Mutationen gefunden, die für die Entstehung des Bernard-Soulier-Syndroms verantwortlich sind. Über 30 verschiedene Mutationen im GPIb-Alpha-, GPIb-Beta- oder GPIX-Gen wurden in Assoziation mit dem Bernard-Soulier-Syndrom beschrieben.[4]
Epidemiologie und Prävalenz
Das Bernard-Soulier-Syndrom ist eine ausgesprochen seltene Erkrankung. Bisher sind weltweit etwa 100 Fälle in der Literatur beschrieben. Die Prävalenz wird auf 0,1:100.000 geschätzt, allerdings liegt sie bedingt durch Fehldiagnosen und Nichterkennung wahrscheinlich höher.[5]
Symptome und Diagnose
Das Bernard-Soulier-Syndrom manifestiert sich durch Blutungsneigung und sogenannte Riesen-Thrombozyten (Makrothrombozyten). Bei einem Teil der Patienten kann zudem die Thrombozytenzahl vermindert sein (Thrombozytopenie).[6] Die Thrombozytenzahl liegt bei BSS-Patienten im Bereich von kleiner 30.000 bis 200.000 pro µl (normal: 150.000 bis 400.000). Der Durchmesser der Thrombozyten liegt bei 4 bis 10 µm (normal: 1 bis 4 µm). Die Blutungsdauer liegt zwischen 5 und mehr als 20 Minuten (normal: 2 bis 7 min).[7][3]
Klinisch kann sich das Bernard-Soulier-Syndrom durch starkes Nasen- und Zahnfleischbluten, gastrointestinale Blutungen, sowie durch Purpura (Kapillarblutungen) manifestieren. Bei Frauen kann es zu einer verlängerten Regelblutung (einer Menorrhagie) beziehungsweise einer Hypermenorrhoe kommen.
Über die verlängerte Blutungszeit an der Haut, dem Auftreten von Riesen-Thrombozyten (Makrothrombozytopenie), dem in-vitro Ausbleiben der Agglutination (Aggregation der Thrombozyten) bei Zusatz von Ristocetin zum Blut, sowie anhand der niedrigen oder fehlenden Expression der GPIb-V-IX-Komplexe, kann eine sichere Diagnose gestellt werden.[8]
Therapie
Die Therapie erfolgt – wenn notwendig – im Wesentlichen symptomatisch. Vor Operationen ist unter Umständen eine Thrombozytentransfusion notwendig.
Prognose
Die Prognose ist in der Regel für die Patienten günstig.
Einzelnachweise
- ↑ J. Bernard, J. P. Soulier: Sur une nouvelle variété de dystrophie thrombocytaire-hémorragipare congeénitale. In: Semin Hop Paris. 24, 1948, S. 3217.
- ↑ José A. López, Robert K. Andrews, Vahid Afshar-Kharghan, Michael C. Berndt: Bernard-Soulier Syndrome. In: Blood. 91, 1998, S. 4397–4418. (PDF)
- ↑ a b c F. Lanza: Hemorrhagiparous Thrombocytic Dystrophy. (Memento vom 3. November 2005 im Internet Archive) In: Orphanet Encyclopedia. Oktober 2003.
- ↑ S. Kunishima u. a.: Genetic abnormalities of Bernard-Soulier syndrome. In: Int J Hematol. 76/2002, S. 319–327. PMID 12463594
- ↑ V. Sundararajan, G. S. Retzinger: Bernard-Soulier Syndrome. (Memento des vom 28. November 2015 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. In: LabLines. Educational Bulletin 8/2002.
- ↑ J. A. Lopez u. a.: Bernard-Soulier syndrome. In: Blood. 91/1998, S. 4397–4418. PMID 9616133
- ↑ The University of Chicago Genetic Services Laboratories: GP Ibß analysis for Bernard-Soulier Syndrome. (Memento vom 1. August 2007 im Internet Archive)
- ↑ F. Lanza: Bernard-Soulier-Syndrom orpha.net
Literatur
- S2k-Leitlinie Thrombozytopathien der Gesellschaft für Thrombose- und Hämostaseforschung (GTH). In: AWMF online (Stand 2012)
- F. Lanza: Bernard-Soulier syndrome (hemorrhagiparous thrombocytic dystrophy). In: Orphanet J Rare Dis. 16/2006, S. 46. PMID 17109744
- J. P. Caen u. a.: Bernard-Soulier syndrome: a new platelet glycoprotein abnormality. Its relationship with platelet adhesion to subendothelium and with the factor VIII von Willebrand protein. In: J. Lab. Clin. Med. 87/1976, S. 587–596.
Weblinks
- Bernard-Soulier Syndrome Organization
- Bernard-Soulier-Syndrom. In: Online Mendelian Inheritance in Man. (englisch)
- onkodin.de: Hereditäre Thrombozytopenien. (Memento vom 5. Mai 2008 im Webarchiv archive.today) Abbildung von Makrothrombozyten bei BSS
- Royal College of Surgeons in Ireland: Bernard-Soulier Syndrome
Auf dieser Seite verwendete Medien
Rasterelektronenmikroskop (REM)-Aufnahme, eingefärbt: Erythrozyt, Thrombozyt, Leukozyt (von links nach rechts)