Berkelium
| Eigenschaften | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemein | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name, Symbol, Ordnungszahl | Berkelium, Bk, 97 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elementkategorie | Actinoide | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppe, Periode, Block | Ac, 7, f | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aussehen | silberweiß | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-Nummer | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomar[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atommasse | 247 u | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomradius | 170 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronenkonfiguration | [Rn] 5f9 7s2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. Ionisierungsenergie | 6.19785(25) eV[2] ≈ 598 kJ/mol[3] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. Ionisierungsenergie | 11.9(4) eV[2] ≈ 1150 kJ/mol[3] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. Ionisierungsenergie | 21.6(4) eV[2] ≈ 2080 kJ/mol[3] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4. Ionisierungsenergie | 36.0(4) eV[2] ≈ 3470 kJ/mol[3] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5. Ionisierungsenergie | 56.0(1,9) eV[2] ≈ 5400 kJ/mol[3] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physikalisch[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aggregatzustand | fest | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristallstruktur | hexagonal | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dichte | 14,78 g·cm−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzpunkt | 1259 K (986 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molares Volumen | 16,84·10−6 m3·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemisch[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidationszustände | +3, +4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Normalpotential | −2,00 V (Bk3+ + 3 e− → Bk)[4] −1,08 V (Bk4+ +4 e− → Bk)[4] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativität | 1,30 (Pauling-Skala) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotope | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Weitere Isotope siehe Liste der Isotope | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gefahren- und Sicherheitshinweise | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Radioaktiv | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Berkelium ist ein künstlich erzeugtes chemisches Element mit dem Elementsymbol Bk und der Ordnungszahl 97. Im Periodensystem steht es in der Gruppe der Actinoide (7. Periode, f-Block) und zählt auch zu den Transuranen. Berkelium wurde nach der Stadt Berkeley in Kalifornien benannt, in der es entdeckt wurde. Bei Berkelium handelt es sich um ein radioaktives Metall mit einem silbrig-weißen Aussehen. Es wurde im Dezember 1949 erstmals aus dem leichteren Element Americium erzeugt. Es entsteht in geringen Mengen in Kernreaktoren. Seine Anwendung findet es vor allem zur Erzeugung höherer Transurane und Transactinoide.
Geschichte



So wie Americium (Ordnungszahl 95) und Curium (96) in den Jahren 1944 und 1945 nahezu zeitgleich entdeckt wurden, erfolgte in ähnlicher Weise in den Jahren 1949 und 1950 die Entdeckung der Elemente Berkelium (97) und Californium (98).
Die Experimentatoren Glenn T. Seaborg, Albert Ghiorso und Stanley G. Thompson stellten am 19. Dezember 1949 die ersten Kerne im 60-Zoll-Zyklotron der Universität von Kalifornien in Berkeley her. Es war das fünfte Transuran, das entdeckt wurde. Die Entdeckung wurde zeitgleich mit der des Californiums veröffentlicht.[7][8][9][10]
Die Namenswahl folgte naheliegenderweise einem gemeinsamen Ursprung: Berkelium wurde nach dem Fundort, der Stadt Berkeley in Kalifornien, benannt. Die Namensgebung folgt somit wie bei vielen Actinoiden und den Lanthanoiden: Terbium, das im Periodensystem genau über Berkelium steht, wurde nach der schwedischen Stadt Ytterby benannt, in der es zuerst entdeckt wurde: It is suggested that element 97 be given the name berkelium (symbol Bk) after the city of Berkeley in a manner similar to that used in naming its chemical homologue terbium (atomic number 65) whose name was derived from the town of Ytterby, Sweden, where the rare earth minerals were first found.[8] Für das Element 98 wählte man den Namen Californium zu Ehren der Universität und des Staates Kalifornien.
Als schwerste Schritte in der Vorbereitung zur Herstellung des Elements erwiesen sich die Entwicklung entsprechender chemischer Separationsmethoden und die Herstellung ausreichender Mengen an Americium für das Target-Material.
Die Probenvorbereitung erfolgte zunächst durch Auftragen von Americiumnitratlösung (mit dem Isotop 241Am) auf eine Platinfolie; die Lösung wurde eingedampft und der Rückstand dann zum Oxid (AmO2) geglüht.
Nun wurde diese Probe im 60-Zoll-Zyklotron mit beschleunigten α-Teilchen mit einer Energie von 35 MeV etwa 6 Stunden beschossen. Dabei entsteht in einer sogenannten (α,2n)-Reaktion 243Bk sowie zwei freie Neutronen:
Nach dem Beschuss im Zyklotron wurde die Beschichtung mittels Salpetersäure gelöst und erhitzt, anschließend wieder mit einer konzentrierten wässrigen Ammoniak-Lösung als Hydroxid ausgefällt und abzentrifugiert; der Rückstand wurde wiederum in Salpetersäure gelöst.
Um die weitgehende Abtrennung des Americiums zu erreichen, wurde diese Lösung mit einem Gemisch von Ammoniumperoxodisulfat und Ammoniumsulfat versetzt und erhitzt, um vor allem das gelöste Americium auf die Oxidationsstufe +6 zu bringen. Nicht oxidiertes restliches Americium wurde durch Zusatz von Flusssäure als Americium(III)-fluorid ausgefällt. Auf diese Weise werden auch begleitendes Curium als Curium(III)-fluorid und das erwartete Element 97 (Berkelium) als Berkelium(III)-fluorid ausgefällt. Dieser Rückstand wurde durch Behandlung mit Kalilauge zum Hydroxid umgewandelt, welches nach Abzentrifugieren nun in Perchlorsäure gelöst wurde.
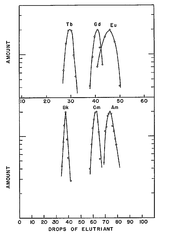
Die weitere Trennung erfolgte in Gegenwart eines Citronensäure/Ammoniumcitrat-Puffers im schwach sauren Medium (pH ≈ 3,5) mit Ionenaustauschern bei erhöhter Temperatur.
Die chromatographische Trennung konnte nur aufgrund vorheriger Vergleiche mit dem chemischen Verhalten der entsprechenden Lanthanoide gelingen. So tritt bei einer Trennung das Terbium vor Gadolinium und Europium aus einer Säule. Falls das chemische Verhalten des Berkeliums dem eines Eka-Terbiums ähnelt, sollte das fragliche Element 97 daher in dieser analogen Position zuerst erscheinen, entsprechend vor Curium und Americium.
Der weitere Verlauf des Experiments brachte zunächst kein Ergebnis, da man nach einem α-Teilchen als Zerfallssignatur suchte. Erst die Suche nach charakteristischer Röntgenstrahlung und Konversionselektronen als Folge eines Elektroneneinfangs brachte den gewünschten Erfolg. Das Ergebnis der Kernreaktion wurde mit 243Bk angegeben, obwohl man anfänglich auch 244Bk für möglich hielt.
Im Jahr 1958 isolierten Burris B. Cunningham und Stanley G. Thompson erstmals wägbare Mengen, die durch langjährige Neutronenbestrahlung von 239Pu in dem Testreaktor der National Reactor Testing Station in Idaho erzeugt wurden.[11]
Isotope
Von Berkelium existieren nur Radionuklide und keine stabilen Isotope. Insgesamt sind 12 Isotope und 5 Kernisomere des Elements bekannt. Die langlebigsten sind 247Bk (Halbwertszeit 1380 Jahre), 248Bk (9 Jahre) und 249Bk (330 Tage). Die Halbwertszeiten der restlichen Isotope liegen im Bereich von Millisekunden bis Stunden oder Tagen.[5]
Nimmt man beispielhaft den Zerfall des langlebigsten Isotops 247Bk heraus, so entsteht durch α-Zerfall zunächst das langlebige 243Am, das seinerseits durch erneuten α-Zerfall in 239Np übergeht. Der weitere Zerfall führt dann über 239Pu zum 235U, dem Beginn der Uran-Actinium-Reihe (4 n + 3).
- Die angegebenen Zeiten sind Halbwertszeiten.
Vorkommen
Berkeliumisotope kommen auf der Erde wegen ihrer im Vergleich zum Alter der Erde zu geringen Halbwertszeit nicht natürlich vor.
Über die Erstentdeckung von Einsteinium und Fermium in den Überresten der ersten amerikanischen Wasserstoffbombe, Ivy Mike, am 1. November 1952 auf dem Eniwetok-Atoll hinaus wurden neben Plutonium und Americium auch Isotope von Curium, Berkelium und Californium gefunden, darunter das 249Bk, das durch den β-Zerfall in 249Cf übergeht. Aus Gründen der militärischen Geheimhaltung wurden die Ergebnisse erst später im Jahr 1956 publiziert.[12]
In Kernreaktoren entsteht vor allem das Berkeliumisotop 249Bk, es zerfällt bereits während der Zwischenlagerung (vor der Endlagerung) fast komplett zum Californiumisotop 249Cf mit 351 Jahren Halbwertszeit. Dieses zählt zum Transuranabfall und ist daher in der Endlagerung unerwünscht.
Gewinnung und Darstellung
Berkelium wird durch Beschuss von leichteren Actinoiden mit Neutronen in einem Kernreaktor erzeugt. Die Hauptquelle ist der 85 MW High-Flux-Isotope Reactor (HFIR) am Oak Ridge National Laboratory in Tennessee, USA, der auf die Herstellung von Transcuriumelementen (Z > 96) eingerichtet ist.[13]
Gewinnung von Berkeliumisotopen
Berkelium entsteht in Kernreaktoren aus Uran (238U) oder Plutonium (239Pu) durch zahlreiche nacheinander folgende Neutroneneinfänge und β-Zerfälle – unter Ausschluss von Spaltungen oder α-Zerfällen.[14]
Ein wichtiger Schritt ist hierbei die (n,γ)- oder Neutroneneinfangsreaktion, bei welcher das gebildete angeregte Tochternuklid durch Aussendung eines γ-Quants in den Grundzustand übergeht. Die hierzu benötigten freien Neutronen entstehen durch Kernspaltung anderer Kerne im Reaktor. In diesem kernchemischen Prozess wird zunächst durch eine (n,γ)-Reaktion gefolgt von zwei β−-Zerfällen das 239Pu gebildet. In Brutreaktoren wird dieser Prozess zum Erbrüten neuen Spaltmaterials genutzt.
- Bei den angegebenen Zeiten handelt es sich um Halbwertszeiten.
Letzteres wird hierzu mit einer Neutronenquelle, die einen hohen Neutronenfluss besitzt, bestrahlt. Die hierbei möglichen Neutronenflüsse sind um ein Vielfaches höher als in einem Kernreaktor. Aus 239Pu wird durch vier aufeinander folgende (n,γ)-Reaktionen 243Pu gebildet, welches durch β-Zerfall mit einer Halbwertszeit von 4,96 Stunden zu 243Am zerfällt. Das durch eine weitere (n,γ)-Reaktion gebildete 244Am zerfällt wiederum durch β-Zerfall mit einer Halbwertszeit von 10,1 Stunden letztlich zu 244Cm. Aus 244Cm entstehen durch weitere (n,γ)-Reaktionen im Reaktor in jeweils kleiner werdenden Mengen die nächst schwereren Isotope.
Die Entstehung von 250Cm auf diesem Wege ist jedoch sehr unwahrscheinlich, da 249Cm nur eine kurze Halbwertszeit besitzt und so weitere Neutroneneinfänge in der kurzen Zeit unwahrscheinlich sind.
249Bk ist das einzige Isotop des Berkeliums, das auf diese Weise gebildet werden kann. Es entsteht durch β-Zerfall aus 249Cm – das erste Curiumisotop, welches einen β-Zerfall eingeht (Halbwertszeit 64,15 min[5]).
Durch Neutroneneinfang entsteht zwar aus 249Bk auch das 250Bk, dies zerfällt aber schon mit einer Halbwertszeit von 3,212 Stunden[5] durch β-Zerfall zu 250Cf.[15][16]
Das langlebigste Isotop, das 247Bk, kann somit nicht in Kernreaktoren hergestellt werden, so dass man sich oftmals mit dem eher zugänglichen 249Bk begnügen muss. Berkelium steht heute weltweit lediglich in sehr geringen Mengen zur Verfügung, weshalb es einen sehr hohen Preis besitzt. Dieser beträgt etwa 185 US-Dollar pro Mikrogramm 249Bk.[17]
Das Isotop 248Bk wurde 1956 durch Beschuss mit 25-MeV α-Teilchen aus einem Gemisch von Curiumnukliden hergestellt. Seine Existenz mit dessen Halbwertszeit von 23 ± 5 Stunden wurde durch das β-Zerfallsprodukt 248Cf festgestellt.[18]
247Bk wurde 1965 aus 244Cm durch Beschuss mit α-Teilchen hergestellt. Ein eventuell entstandenes Isotop 248Bk konnte nicht nachgewiesen werden.[19]
Das Berkeliumisotop 242Bk wurde 1979 durch Beschuss von 235U mit 11B, 238U mit 10B, sowie 232Th mit 14N bzw. 15N erzeugt. Es wandelt sich durch Elektroneneinfang mit einer Halbwertszeit von 7,0 ± 1,3 Minuten zum 242Cm um. Eine Suche nach einem zunächst vermuteten Isotop 241Bk blieb ohne Erfolg.[20]
Darstellung elementaren Berkeliums
Die ersten Proben von Berkeliummetall wurden 1969 durch Reduktion von BkF3 bei 1000 °C mit Lithium in Reaktionsapparaturen aus Tantal hergestellt.[21]
Elementares Berkelium kann ferner auch aus BkF4 mit Lithium oder durch Reduktion von BkO2 mit Lanthan oder Thorium dargestellt werden.[22]
Eigenschaften

(Größe ca. 100 μm)
Im Periodensystem steht das Berkelium mit der Ordnungszahl 97 in der Reihe der Actinoide, sein Vorgänger ist das Curium, das nachfolgende Element ist das Californium. Sein Analogon in der Reihe der Lanthanoide ist das Terbium.

(A: grün; B: blau; C: rot).
Physikalische Eigenschaften
Berkelium ist ein radioaktives Metall mit silbrig-weißem Aussehen und einem Schmelzpunkt von 986 °C.
Die bei Standardbedingungen auftretende Modifikation α-Bk kristallisiert im hexagonalen Kristallsystem in der Raumgruppe P63/mmc (Raumgruppen-Nr. 194) mit den Gitterparametern a = 341,6 ± 0,3 pm und c = 1106,9 ± 0,7 pm sowie vier Formeleinheiten pro Elementarzelle, einem Metallradius von 170 pm und einer Dichte von 14,78 g/cm3. Die Kristallstruktur besteht aus einer doppelt-hexagonal dichtesten Kugelpackung (d. h.c.p.) mit der Schichtfolge ABAC und ist damit isotyp zur Struktur von α-La.[21]
Bei höheren Temperaturen geht α-Bk in β-Bk über. Die β-Modifikation kristallisiert im kubischen Kristallsystem in der Raumgruppe Fm3m (Nr. 225) mit dem Gitterparameter a = 499,7 ± 0,4 pm, einem Metallradius von 177 pm und einer Dichte von 13,25 g/cm3. Die Kristallstruktur besteht aus einer kubisch dichtesten Kugelpackung mit der Stapelfolge ABC, was einem kubisch flächenzentrierten Gitter (f.c.c.) entspricht.[21]
Die Lösungsenthalpie von Berkelium-Metall in Salzsäure bei Standardbedingungen beträgt −600,2 ± 5,1 kJ·mol−1. Ausgehend von diesem Wert erfolgte die erstmalige Berechnung der Standardbildungsenthalpie (ΔfH0) von Bk3+(aq) auf −601 ± 5 kJ·mol−1 und des Standardpotentials Bk3+ / Bk0 auf −2,01 ± 0,03 V.[23]
Zwischen 70 K und Raumtemperatur verhält sich Berkelium wie ein Curie-Weiss-Paramagnet mit einem effektiven magnetischen Moment von 9,69 Bohrschen Magnetonen (µB) und einer Curie-Temperatur von 101 K. Beim Abkühlen auf etwa 34 K erfährt Berkelium einen Übergang zu einem antiferromagnetischen Zustand.[24] Dieses magnetische Moment entspricht fast dem theoretischen Wert von 9,72 µB.[25][26]
Chemische Eigenschaften
Berkelium ist wie alle Actinoide sehr reaktionsfähig. Es reagiert allerdings nicht schnell mit Sauerstoff bei Raumtemperatur, was möglicherweise auf die Bildung einer schützenden Oxidschicht zurückzuführen ist. Jedoch reagiert es mit geschmolzenen Metallen, Wasserstoff, Halogenen, Chalkogenen und Penteliden zu verschiedenen binären Verbindungen.[25][26]
In wässriger Lösung ist die dreiwertige Oxidationsstufe am beständigsten, jedoch kennt man auch vierwertige und zweiwertige[27] Verbindungen. Wässrige Lösungen mit Bk3+-Ionen haben eine gelbgrüne Farbe, mit Bk4+-Ionen sind sie in salzsaurer Lösung beige, in schwefelsaurer Lösung orange-gelb.[28][29][30] Ein ähnliches Verhalten ist für sein Lanthanoidanalogon Terbium zu beobachten.[9][10]
Bk3+-Ionen zeigen zwei scharfe Fluoreszenzpeaks bei 652 nm (rotes Licht) und 742 nm (dunkelrot – nahes Infrarot) durch interne Übergänge in der f-Elektronen-Schale.[31][32]
Spaltbarkeit
Berkelium eignet sich anders als die benachbarten Elemente Curium und Californium auch theoretisch nur sehr schlecht als Kernbrennstoff in einem Reaktor. Neben der sehr geringen Verfügbarkeit und dem damit verbundenen hohen Preis kommt hier erschwerend hinzu, dass die günstigeren Isotope mit gerader Massenzahl nur eine geringe Halbwertszeit haben. Das einzig infrage kommende geradzahlige Isotop, 248Bk im Grundzustand, ist nur sehr schwer zu erzeugen,[33] zudem liegen keine ausreichenden Daten über dessen Wirkungsquerschnitte vor.[34][35]
249Bk ist im Prinzip in der Lage, eine Kettenreaktion aufrechtzuerhalten, und damit für einen schnellen Reaktor oder eine Atombombe geeignet. Die kurze Halbwertszeit von 330 Tagen zusammen mit der komplizierten Gewinnung und dem hohen Bedarf vereiteln entsprechende Versuche. Die kritische Masse liegt unreflektiert bei 192 kg, mit Wasserreflektor immer noch 179 kg, ein Vielfaches der Weltjahresproduktion.[36]
247Bk kann sowohl in einem thermischen als auch in einem schnellen Reaktor eine Kettenreaktion aufrechterhalten und hat mit 1380 Jahren eine ausreichend große Halbwertszeit, um sowohl als Kernbrennstoff als auch Spaltstoff für eine Atombombe zu dienen. Es kann allerdings nicht in einem Reaktor erbrütet werden und ist damit in der Produktion noch aufwendiger und kostenintensiver als die anderen genannten Isotope. Damit einher geht eine noch geringere Verfügbarkeit, was angesichts der benötigten Masse von mindestens 35,2 kg (kritische Masse mit Stahlreflektor) als Ausschlusskriterium angesehen werden kann.[36]
Verwendung

Die Verwendung für Berkeliumisotope liegt hauptsächlich in der wissenschaftlichen Grundlagenforschung. 249Bk ist ein gängiges Nuklid zur Synthese noch schwererer Transurane und Transactinoide wie Lawrencium, Rutherfordium und Bohrium.[38] Es dient auch als Quelle für das Isotop 249Cf, welches Studien über die Chemie des Californiums ermöglicht. Es hat den Vorzug vor dem radioaktiveren 252Cf, welches ansonsten durch Neutronenbeschuss im High-Flux-Isotope Reactor (HFIR) erzeugt wird.[39]
Eine 22-Milligramm-Probe 249Bk wurde im Jahr 2009 in einer 250-Tage-Bestrahlung hergestellt und dann in einem 90-Tage-Prozess in Oak Ridge gereinigt. Diese Probe führte zu den ersten 6 Atomen des Elements Tenness am Vereinigten Institut für Kernforschung (JINR), Dubna, Russland, nach einem Beschuss mit Calcium-Ionen im U400-Zyklotron für 150 Tage. Diese Synthese war ein Höhepunkt der russisch-amerikanischen Zusammenarbeit zwischen JINR und Lawrence Livermore National Laboratory bei der Synthese der Elemente 113 bis 118, die 1989 gestartet wurde.[40][41]
Verbindungen
→ Kategorie: Berkeliumverbindung
Obwohl das Isotop 247Bk die längste Halbwertszeit ausweist, ist das Isotop 249Bk leichter zugänglich und wird überwiegend für die Bestimmung der chemischen Eigenschaften herangezogen.
Oxide
Von Berkelium existieren Oxide der Oxidationsstufen +3 (Bk2O3) und +4 (BkO2).[42][43]
Berkelium(IV)-oxid (BkO2) ist ein brauner Feststoff und kristallisiert im kubischen Kristallsystem in der Fluorit-Struktur in der Raumgruppe Fm3m (Raumgruppen-Nr. 225) mit den Koordinationszahlen Cf[8], O[4]. Der Gitterparameter beträgt 533,4 ± 0,5 pm.[44]
Berkelium(III)-oxid (Bk2O3) entsteht aus BkO2 durch Reduktion mit Wasserstoff:
Es ist ein gelbgrüner Feststoff mit einem Schmelzpunkt von 1920 °C.[45] Es bildet ein kubisch-raumzentriertes Kristallgitter mit a = 1088,0 ± 0,5 pm.[44]
Halogenide
Halogenide sind für die Oxidationsstufen +3 und +4 bekannt.[46] Die stabilste Stufe +3 ist für sämtliche Verbindungen von Fluor bis Iod bekannt und auch in wässriger Lösung stabil. Die vierwertige Stufe ist nur in der festen Phase stabilisierbar.
| Oxidations- zahl | Fluor | Chlor | Brom | Iod |
|---|---|---|---|---|
| +3 | Berkelium(III)-fluorid BkF3 gelbgrün | Berkelium(III)-chlorid BkCl3 grün | Berkelium(III)-bromid BkBr3 gelbgrün | Berkelium(III)-iodid BkI3 gelb |
| +4 | Berkelium(IV)-fluorid BkF4 gelbgrün |
Berkelium(IV)-fluorid (BkF4) ist eine gelbgrüne Ionenverbindung und kristallisiert im monoklinen Kristallsystem und ist isotyp mit Uran(IV)-fluorid.[47]
Berkelium(III)-fluorid (BkF3) ist ein gelbgrüner Feststoff und besitzt zwei kristalline Strukturen, die temperaturabhängig sind (Umwandlungstemperatur: 350 bis 600 °C). Bei niedrigen Temperaturen ist die orthorhombische Struktur (YF3-Typ) zu finden. Bei höheren Temperaturen bildet es ein trigonales System (LaF3-Typ).[48][47]
Berkelium(III)-chlorid (BkCl3) ist ein grüner Feststoff mit einem Schmelzpunkt von 603 °C[46] und kristallisiert im hexagonalen Kristallsystem.[49][50] Seine Kristallstruktur ist isotyp mit Uran(III)-chlorid (UCl3). Das Hexahydrat (BkCl3 · 6 H2O) weist eine monokline Kristallstruktur auf.[51]
Berkelium(III)-bromid (BkBr3) ist ein gelbgrüner Feststoff und kristallisiert bei niedrigen Temperaturen im PuBr3-Typ, bei höheren Temperaturen im AlCl3-Typ.[52]
Berkelium(III)-iodid (BkI3) ist ein gelber Feststoff und kristallisiert im hexagonalen System (BiI3-Typ).[53][54][55]
Die Oxihalogenide BkOCl, BkOBr und BkOI besitzen eine tetragonale Struktur vom PbFCl-Typ.[56][57]
Chalkogenide und Pentelide
Berkelium(III)-sulfid (Bk2S3) wurde entweder durch Behandeln von Berkelium(III)-oxid mit einem Gemisch von Schwefelwasserstoff und Kohlenstoffdisulfid bei 1130 °C dargestellt, oder durch die direkte Umsetzung von metallischem Berkelium mit Schwefel. Dabei entstanden bräunlich-schwarze Kristalle mit kubischer Symmetrie und einer Gitterkonstanten von a = 844 pm.[56][58]
Die Pentelide des Berkeliums (249Bk) des Typs BkX sind für die Elemente Stickstoff,[59] Phosphor, Arsen und Antimon dargestellt worden. Ihre Herstellung erfolgt durch die Reaktion von entweder Berkelium(III)-hydrid (BkH3) oder metallischem Berkelium mit diesen Elementen bei erhöhter Temperatur im Hochvakuum in Quarzampullen. Sie kristallisieren im NaCl-Gitter mit den Gitterkonstanten 495,1 pm für BkN, 566,9 pm für BkP, 582,9 pm für BkAs und 619,1 pm für BkSb.[60]
Weitere anorganische Verbindungen
Berkelium(III)- und Berkelium(IV)-hydroxid sind beide als Suspension in 1 M Natronlauge stabil und wurden spektroskopisch untersucht.[61] Berkelium(III)-phosphat (BkPO4) wurde als Feststoff dargestellt, der eine starke Fluoreszenz bei einer Anregung durch einen Argon-Laser (514,5 nm-Linie) zeigt.[62][63]
Weitere Salze des Berkeliums sind bekannt, z. B. Bk2O2S, (BkNO3)3 · 4 H2O, BkCl3 · 6 H2O, Bk2(SO4)3 · 12 H2O und Bk2(C2O4)3 · 4 H2O.[64][58] Eine thermische Zersetzung in einer Argonatmosphäre bei ca. 600 °C (um eine Oxidation zum BkO2 vermeiden) von Bk2(SO4)3 · 12 H2O führt zu raumzentrierten orthorhombischen Kristallen von Berkelium(III)-oxisulfat (Bk2O2SO4). Diese Verbindung ist unter Schutzgas bis mindestens 1000 °C thermisch stabil.[65][58]
Berkeliumhydride werden durch Umsetzung des Metalls mit Wasserstoffgas bei Temperaturen über 250 °C hergestellt.[59] Sie bilden nicht-stöchiometrische Zusammensetzungen mit der nominalen Formel BkH2+x (0 < x < 1). Während die Trihydride eine hexagonale Symmetrie besitzen, kristallisiert das Dihydrid in einer fcc-Struktur mit der Gitterkonstanten a = 523 pm.[56][66]
Metallorganische Verbindungen
Berkelium bildet einen trigonalen (η5–C5H5)3Bk-Komplex mit drei Cyclopentadienylringen, die durch Umsetzung von Berkelium(III)-chlorid mit geschmolzenem Be(C5H5)2 bei etwa 70 °C synthetisiert werden können. Es besitzt eine gelbe Farbe und orthorhombische Symmetrie mit den Gitterkonstanten a = 1411 pm, b = 1755 pm und c = 963 pm sowie einer berechneten Dichte von 2,47 g/cm3. Der Komplex ist bis mindestens 250 °C stabil und sublimiert bei ca. 350 °C. Die hohe Radioaktivität bewirkt allerdings eine schnelle Zerstörung der Verbindungen innerhalb weniger Wochen.[67][68] Ein C5H5-Ring im (η5–C5H5)3Bk kann durch Chlor ersetzt werden, wobei das dimere [Bk(C5H5)2Cl]2 entsteht. Das optische Absorptionsspektrum dieser Verbindung ist sehr ähnlich zum (η5–C5H5)3Bk.[69][65][70]
Sicherheitshinweise
Einstufungen nach der CLP-Verordnung liegen nicht vor, weil diese nur die chemische Gefährlichkeit umfassen und eine völlig untergeordnete Rolle gegenüber den auf der Radioaktivität beruhenden Gefahren spielen. Auch Letzteres gilt nur, wenn es sich um eine dafür relevante Stoffmenge handelt.
Literatur
- David E. Hobart and Joseph R. Peterson: Berkelium; in: Lester R. Morss, Norman M. Edelstein, Jean Fuger (Hrsg.): The Chemistry of the Actinide and Transactinide Elements, Springer, Dordrecht 2006; ISBN 1-4020-3555-1, S. 1444–1498 (doi:10.1007/1-4020-3598-5_10).
- Gmelins Handbuch der anorganischen Chemie, System Nr. 71, Transurane: Teil A 1 I, S. 38–40; Teil A 1 II, S. 19, 326–336; Teil B 1, S. 72–76.
- The Solution Absorption Spectrum of Bk3+ and the Crystallography of Berkelium Dioxide, Sesquioxide, Trichloride, Oxychloride, and Trifluoride, Ph.D. Thesis, Joseph Richard Peterson, October 1967, U. S. Atomic Energy Commission Document Number UCRL-17875 (1967).
- J. R. Peterson, D. E. Hobart: The Chemistry of Berkelium; in: Harry Julius Emeleus (Hrsg.): Advances in inorganic chemistry and radiochemistry, Volume 28, Academic Press, 1984, ISBN 0-12-023628-1, S. 29–64 (doi:10.1016/S0898-8838(08)60204-4, eingeschränkte Vorschau in der Google-Buchsuche).
- G. T. Seaborg (Hrsg.): Proceedings of the 'Symposium Commemorating the 25th Anniversary of the Discovery of Elements 97 and 98', 20. Januar 1975; Report LBL-4366, Juli 1976.
Weblinks
- Eintrag zu Berkelium. In: Römpp Online. Georg Thieme Verlag, abgerufen am 3. Januar 2015.
- Amanda Yarnell: Berkelium, Chemical & Engineering News, 2003.
Einzelnachweise
- ↑ Die Werte der atomaren und physikalischen Eigenschaften (Infobox) sind, wenn nicht anders angegeben, entnommen aus: David E. Hobart and Joseph R. Peterson: Berkelium. Hrsg.: Lester R. Morss, Norman M. Edelstein, Jean Fuger. Springer, Dordrecht 2006, ISBN 1-4020-3555-1, S. 1444–1498, doi:10.1007/1-4020-3598-5_10 (nevada.edu [PDF; abgerufen am 30. März 2019]).
- ↑ a b c d e Eintrag zu berkelium in Kramida, A., Ralchenko, Yu., Reader, J. und NIST ASD Team (2019): NIST Atomic Spectra Database (ver. 5.7.1). Hrsg.: NIST, Gaithersburg, MD. doi:10.18434/T4W30F (physics.nist.gov/asd). Abgerufen am 13. Juni 2020.
- ↑ a b c d e Eintrag zu berkelium bei WebElements, www.webelements.com, abgerufen am 13. Juni 2020.
- ↑ a b Hobart, Peterson (2006), S. 1482.
- ↑ a b c d G. Audi, O. Bersillon, J. Blachot, A. H. Wapstra: The NUBASE evaluation of nuclear and decay properties; in: Nuclear Physics A, 2003, 729 (1), S. 3–128. doi:10.1016/j.nuclphysa.2003.11.001. (PDF; 1,0 MB).
- ↑ Die von der Radioaktivität ausgehenden Gefahren gehören nicht zu den einzustufenden Eigenschaften nach der GHS-Kennzeichnung. In Bezug auf weitere Gefahren wurde dieses Element entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ S. G. Thompson, A. Ghiorso, G. T. Seaborg: Element 97; in: Physical Review, 1950, 77 (6), S. 838–839 (doi:10.1103/PhysRev.77.838.2).
- ↑ a b c S. G. Thompson, A. Ghiorso, G. T. Seaborg: The New Element Berkelium (Atomic Number 97); in: Physical Review, 1950, 80 (5), S. 781–789 (doi:10.1103/PhysRev.80.781; Maschinoskript (26. April 1950) (PDF; 1,8 MB)).
- ↑ a b Stanley G. Thompson, Glenn T. Seaborg: Chemical Properties of Berkelium (doi:10.2172/932812; Abstract; Maschinoskript (24. Februar 1950)).
- ↑ a b S. G. Thompson, B. B. Cunningham, G. T. Seaborg: Chemical Properties of Berkelium; in: J. Am. Chem. Soc., 1950, 72 (6), S. 2798–2801 (doi:10.1021/ja01162a538).
- ↑ S. G. Thompson, B. B. Cunningham: First Macroscopic Observations of the Chemical Properties of Berkelium and Californium, supplement to Paper P/825 presented at the Second International Conference of Peaceful Uses Atomic Energy, Geneva, 1958.
- ↑ P. R. Fields, M. H. Studier, H. Diamond, J. F. Mech, M. G. Inghram, G. L. Pyle, C. M. Stevens, S. Fried, W. M. Manning (Argonne National Laboratory, Lemont, Illinois); A. Ghiorso, S. G. Thompson, G. H. Higgins, G. T. Seaborg (University of California, Berkeley, California): Transplutonium Elements in Thermonuclear Test Debris; in: Physical Review, 1956, 102 (1), S. 180–182 (doi:10.1103/PhysRev.102.180).
- ↑ High Flux Isotope Reactor, Oak Ridge National Laboratory; abgerufen am 23. September 2010.
- ↑ S. G. Thompson, A. Ghiorso, B. G. Harvey, G. R. Choppin: Transcurium Isotopes Produced in the Neutron Irradiation of Plutonium; in: Physical Review, 1954, 93 (4), S. 908–908 (doi:10.1103/PhysRev.93.908).
- ↑ L. B. Magnusson, M. H. Studier, P. R. Fields, C. M. Stevens, J. F. Mech, A. M. Friedman, H. Diamond, J. R. Huizenga: Berkelium and Californium Isotopes Produced in Neutron Irradiation of Plutonium; in: Physical Review, 1954, 96 (6), S. 1576–1582 (doi:10.1103/PhysRev.96.1576).
- ↑ T. A. Eastwood, J. P. Butler, M. J. Cabell, H. G. Jackson (Atomic Energy of Canada Limited, Chalk River, Ontario, Canada); R. P. Schuman, F. M. Rourke, T. L. Collins (Knolls Atomic Power Laboratory, Schenectady, New York): Isotopes of Berkelium and Californium Produced by Neutron Irradiation of Plutonium; in: Physical Review, 1957, 107 (6), S. 1635–1638 (doi:10.1103/PhysRev.107.1635).
- ↑ Informationen zum Element Berkelium bei www.speclab.com ( vom 20. Oktober 2007 im Internet Archive) (engl.); abgerufen am: 22. September 2008.
- ↑ E. K. Hulet: New Isotope of Berkelium; in: Physical Review, 1956, 102 (1), S. 182–182 (doi:10.1103/PhysRev.102.182).
- ↑ J. Milsted, A. M. Friedman, C. M. Stevens: The Alpha Half-life of Berkelium-247; a new Long-lived Isomer of Previous Berkelium-248; in: Nuclear Physics, 1965, 71 (2), S. 299–304 (doi:10.1016/0029-5582(65)90719-4).
- ↑ Kimberly E. Williams, Glenn T. Seaborg: New Isotope 242Bk; in: Physical Review C, 1979, 19 (5), S. 1794–1800 (doi:10.1103/PhysRevC.19.1794).
- ↑ a b c J. R. Peterson, J. A. Fahey, R. D. Baybarz: The Crystal Structures and Lattice Parameters of Berkelium Metal; in: J. Inorg. Nucl. Chem., 1971, 33 (10), S. 3345–3351 (doi:10.1016/0022-1902(71)80656-5).
- ↑ J. C. Spirlet, J. R. Peterson, L. B. Asprey; in: Advances in Inorganic Chemistry, Bd. 31 (hrsg. von H. J. Emeléus and A. G. Sharpe), Academic Press, Orlando FL 1987, S. 1–41.
- ↑ J. Fuger, R. G. Haire, J. R. Peterson: A New Determination of the Enthalpy of Solution of Berkelium Metal and the Standard Enthalpy of Formation of Bk3+(aq); in: J. Inorg. Nucl. Chem., 1981, 43 (12), S. 3209–3212 (doi:10.1016/0022-1902(81)80090-5).
- ↑ S. E. Nave, P. G. Huray, R. G. Haire, in: J. E. Crow, R. P. Guertin, T. W. Mihalisin (Hrsg.): Crystalline Electric Field and Structural Effects in f-Electron Systems, Plenum, New York 1980, ISBN 0-306-40443-5, S. 269–274.
- ↑ a b Peterson, Hobart (1984), S. 45.
- ↑ a b Hobart, Peterson (2006), S. 1460.
- ↑ Jim C. Sullivan, K. H. Schmidt, L. R. Morss, C. G. Pippin, C. Williams: Pulse Radiolysis Studies of Berkelium(III): Preparation and Identification of Berkelium(II) in Aqueous Perchlorate Media; in: Inorg. Chem., 1988, 27 (4), S. 597–598 (doi:10.1021/ic00277a005).
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1956.
- ↑ Peterson, Hobart (1984), S. 55.
- ↑ Hobart, Peterson (2006), S. 1472.
- ↑ Z. Assefa, R. G. Haire, N. A. Stump: Emission profile of Bk(III) in a silicate matrix: anomalous dependence on excitation power; in: Journal of Alloys and Compounds, 1998, 271–273, S. 854–858 (doi:10.1016/S0925-8388(98)00233-3).
- ↑ Rita Cornelis, Joe Caruso, Helen Crews, Klaus Heumann: Handbook of Elemental Speciation II: Species in the Environment, Food, Medicine & Occupational Health, John Wiley and Sons, 2005, ISBN 0-470-85598-3, S. 552 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ G. Pfennig, H. Klewe-Nebenius, W. Seelmann-Eggebert (Hrsg.): Karlsruher Nuklidkarte, 7. Aufl., 2006.
- ↑ M. B. Chadwick, P. Oblozinsky, M. Herman at al.: ENDF/B-VII.0: Next Generation Evaluated Nuclear Data Library for Nuclear Science and Technology; in: Nuclear Data Sheets, 2006, 107 (12), S. 2931–3060 (doi:10.1016/j.nds.2006.11.001).
- ↑ A. J. Koning et al.: The JEFF evaluated data project, Proceedings of the International Conference on Nuclear Data for Science and Technology, Nice, 2007 (doi:10.1051/ndata:07476).
- ↑ a b Institut de Radioprotection et de Sûreté Nucléaire: Evaluation of nuclear criticality safety data and limits for actinides in transport, S. 16 (PDF ( vom 18. November 2014 im Internet Archive)).
- ↑ Finally, Element 117 Is Here!, Science Now, abgerufen am: 7. April 2010.
- ↑ Hobart, Peterson (2006), S. 1445–1448.
- ↑ Richard G. Haire:Californium ( vom 17. Juli 2010 im Internet Archive); in: Lester R. Morss, Norman M. Edelstein, Jean Fuger (Hrsg.): The Chemistry of the Actinide and Transactinide Elements, Springer, Dordrecht 2006; ISBN 1-4020-3555-1, S. 1499–1576 (doi:10.1007/1-4020-3598-5_11).
- ↑ Collaboration Expands the Periodic Table, One Element at a Time ( vom 18. Juli 2011 im Internet Archive), Science and Technology Review, Lawrence Livermore National Laboratory, October/November 2010.
- ↑ Nuclear Missing Link Created at Last: Superheavy Element 117, Science daily, abgerufen am: 7. April 2010.
- ↑ Joseph R. Peterson, Burris B. Cunningham: Some Chemical Properties of Element 97 (UCRL-17337); in: Trans. Amer. Nucl. Soc., 1967, 10, S. 92–93 ([1]).
- ↑ J. R. Peterson, B. B. Cunningham: Crystal Structures and Lattice Parameters of the Compounds of Berkelium I. Berkelium Dioxide and Cubic Berkelium Sesquioxide; in: Inorg. Nucl. Chem. Lett., 1967, 3 (9), S. 327–336 (doi:10.1016/0020-1650(67)80037-0).
- ↑ a b R. D. Baybarz: The Berkelium Oxide System; in: J. Inorg. Nucl. Chem., 1968, 30 (7), S. 1769–1773 (doi:10.1016/0022-1902(68)80352-5).
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1972.
- ↑ a b A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1969.
- ↑ a b D. D. Ensor, J. R. Peterson, R. G. Haire, J. P. Young: Absorption Spectrophotometric Study of Berkelium (III) and (IV) Fluorides in the Solid State; in: J. Inorg. Nucl. Chem., 1981, 43 (5), S. 1001–1003 (doi:10.1016/0022-1902(81)80164-9).
- ↑ J. R. Peterson, B. B. Cunningham: Crystal Structures and Lattice Parameters of the Compounds of Berkelium IV. Berkelium Trifluoride; in: J. Inorg. Nucl. Chem., 1968, 30 (7), S. 1775–1784 (doi:10.1016/0022-1902(68)80353-7).
- ↑ J. R. Peterson, B. B. Cunningham: Crystal Structures and Lattice Parameters of the Compounds of Berkelium II. Berkelium Trichloride; in: J. Inorg. Nucl. Chem., 1968, 30 (3), S. 823–828 (doi:10.1016/0022-1902(68)80443-9).
- ↑ J. R. Peterson, J. P. Young, D. D. Ensor, R. G. Haire: Absorption Spectrophotometric and X-Ray Diffraction Studies of the Trichlorides of Berkelium-249 and Californium-249; in: Inorg. Chem., 1986, 25 (21), S. 3779–3782 (doi:10.1021/ic00241a015).
- ↑ John H. Burns, Joseph Richard Peterson: The Crystal Structures of Americium Trichloride Hexahydrate and Berkelium Trichloride Hexahydrate; in: Inorg. Chem., 1971, 10 (1), S. 147–151 (doi:10.1021/ic50095a029).
- ↑ John H. Burns, J. R. Peterson, J. N. Stevenson: Crystallographic Studies of some Transuranic Trihalides: 239PuCl3, 244CmBr3, 249BkBr3 and 249CfBr3; in: J. Inorg. Nucl. Chem., 1975, 37 (3), S. 743–749 (doi:10.1016/0022-1902(75)80532-X).
- ↑ Peterson, Hobart (1984), S. 48.
- ↑ Hobart, Peterson (2006), S. 1469.
- ↑ R. L. Fellows, J. P. Young, R. G. Haire, in: Physical–Chemical Studies of Transuranium Elements (Progress Report April 1976–March 1977) (hrsg. von J. R. Peterson), U.S. Energy Research and Development Administration Document ORO-4447-048, University of Tennessee, Knoxville, S. 5–15.
- ↑ a b c Peterson, Hobart (1984), S. 53.
- ↑ Hobart, Peterson (2006), S. 1465, 1470.
- ↑ a b c Hobart, Peterson (2006), S. 1470.
- ↑ a b J. N. Stevenson, J. R. Peterson: Preparation and Structural Studies of Elemental Curium-248 and the Nitrides of Curium-248 and Berkelium-249; in: Journal of the Less Common Metals, 1979, 66 (2), S. 201–210 (doi:10.1016/0022-5088(79)90229-7).
- ↑ D. Damien, R. G. Haire, J. R. Peterson: Preparation and Lattice Parameters of 249Bk Monopnictides; in: J. Inorg. Nucl. Chem., 1980, 42 (7), S. 995–998 (doi:10.1016/0022-1902(80)80390-3).
- ↑ Hobart, Peterson (2006), S. 1455.
- ↑ Peterson, Hobart (1984), S. 39–40.
- ↑ Hobart, Peterson (2006), S. 1470–1471.
- ↑ Peterson, Hobart (1984), S. 47.
- ↑ a b Peterson, Hobart (1984), S. 54.
- ↑ Hobart, Peterson (2006), S. 1463.
- ↑ Christoph Elschenbroich: Organometallchemie, 6. Auflage, Wiesbaden 2008, ISBN 978-3-8351-0167-8, S. 583–584.
- ↑ Peter G. Laubereau, John H. Burns: Microchemical Preparation of Tricyclopentadienyl Compounds of Berkelium, Californium, and some Lanthanide Elements; in: Inorg. Chem., 1970, 9 (5), S. 1091–1095 (doi:10.1021/ic50087a018).
- ↑ P. G. Lauberau: The formation of dicyclopentadienylberkeliumchloride; in: Inorg. Nucl. Chem. Lett., 1970, 6, S. 611–616 (doi:10.1016/0020-1650(70)80057-5).
- ↑ Hobart, Peterson (2006), S. 1471.
Auf dieser Seite verwendete Medien
Photograph shows the 60-inch cyclotron at the University of California Lawrence Radiation Laboratory, Berkeley, in August, 1939. The metal frame at left is the machine's huge electromagnet. The flat vacuum chamber in which the particles are accelerated is located in the narrow space between the magnet's 60 inch (152 centimeter, 5 foot) pole pieces. The beamline which analyses the particles resulting from the collisions is at right.
The machine was the most powerful particle accelerator in the world at the time. It had started operating early in the year. During the period of the photograph Dr. Edwin M. McMillan was doing the work which led to the discovery of neptunium (element 93) a year later. The instrument was used later by Dr. Glenn T. Seaborg and his colleagues for the discovery of element 94 (plutonium) early in 1941. Subsequently, other transuranium elements were discovered with the machine, as well as many radioisotopes, including carbon-14. For their work, Drs. Seaborg and McMillan shared the Nobel Prize in 1951. The machine was used for the "long bombardments" which produced the first weighable and visible quantities of plutonium, which was used at Chicago by Seaborg and his colleagues to work out the method for separating plutonium on an industrial scale at the Hanford, Washington, plutonium pro...
Autor/Urheber: Gku, Lizenz: CC BY-SA 3.0
Dieses Bild zeigt ein im California Historical Landmark aufgeführtes Objekt in den Vereinigten Staaten. Seine Referenznummer lautet
Physicist Glenn T. Seaborg, atomic pioneer and Commissioner of the Atomic Energy Commission., ca. 1964
A photomicrograph of the first isolated bulk (1.7 micrograms) sample of berkelium. The lump is 100 μm across.
(double hexagonal) closest packing ABAC as found in crystal structures of alpha-La and alpha-Cm (A: green, B: red, C: blue)
Elutionskurven Tb Gd Eu und Bk Cm Am
It took 250 days to make enough berkelium, shown here (in dissolved state), to synthesize element 117.







