Benzidin-Umlagerung
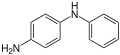
Die Benzidin-Umlagerung oder Zinin-Benzidin-Umlagerung ist eine Namensreaktion in der Organischen Chemie. Entdeckt wurde sie 1863 von dem deutschen Chemiker August Wilhelm von Hofmann (1818–1892).[1] Hofmann konnte zeigen, dass die bereits 1842 von Nikolai Nikolajewitsch Sinin beschriebene Synthese von Benzidin durch Reduktion von Azobenzol mit Ammoniumsulfid über Hydrazobenzol als Zwischenstufe verläuft.[2][3]
Übersichtsreaktion
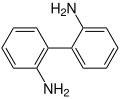
Bei dieser Reaktion entsteht aus Hydrazobenzol (ein N,N'-Diarylhydrazin) in einer intramolekularen Umlagerung im stark sauren Milieu Benzidin (4,4'-Diaminobiphenyl).[4][5]

Reaktionsmechanismus
Im vorgeschlagenen Reaktionsmechanismus entsteht das gewünschte Benzidin 4:[4]

Es wird angenommen, dass das Hydrazobenzol 1 unter saurer Katalyse zunächst doppelt protoniert wird, dabei entsteht das Dikation 2. Bei der Spaltung dieser –N–N-Bindung in 2 bildet sich ein π-komplexartiger Übergangszustand, in dem die Phenyl-Ringe untereinander in para-Stellung zu den Aminogruppen eine σ-Bindung knüpfen unter Bildung von 3. Es kommt also zu einer intramolekularen Umlagerung unter Entstehung des Dikations 3. Eine doppelte Deprotonierung von 3 mit anschließender Rearomatisierung führt zu Benzidin 4.[4][6]
Nebenprodukte
Bei dieser Reaktion entstehen u. a. folgende Nebenprodukte:[7][8]
- 2,2′-Diamino-biphenyl
- 2,4′-Diamino-biphenyl
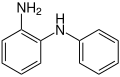
- para-Semidin
- ortho-Semidin
Einzelnachweise
- ↑ Otto-Albrecht Neumüller (Herausgeber): Römpps Chemie Lexikon, 8. Auflage, Frank’sche Verlagshandlung, Stuttgart 1983, ISBN 3-440-04513-7, S. 395.
- ↑ A. W. Hofmann: V. Notes of researches on the polyammonias, No. XXIII.—Hydrazobenzol, a new compound isomeric with benzidine. In: Proceedings of the Royal Society of London. Band 12, 31. Dezember 1863, S. 576, doi:10.1098/rspl.1862.0127.
- ↑ N. Zinin: Ueber das Azobenzid und die Nitrobenzinsäure. In: Journal für Praktische Chemie. Band 36, Nr. 1, 1845, S. 93, doi:10.1002/prac.18450360125.
- ↑ a b c Eberhard Breitmaier, Günther Jung: Organische Chemie: Grundlagen, Verbindungsklassen, Reaktionen, Konzepte, Molekülstruktur, Naturstoffe, Syntheseplanung, Nachhaltigkeit Vol. 7. Georg Thieme Verlag, Stuttgart, 2012, ISBN 978-3-13-541507-9, S. 379–380; 453.
- ↑ Otto-Albrecht Neumüller (Herausgeber): Römpps Chemie Lexikon 8. Auflage, Frank’sche Verlagshandlung, Stuttgart, 1983, ISBN 3-440-04513-7, S. 4704.
- ↑ Bradford P. Mundy, Michael G. Ellerd, Frank G. Favaloro Jr.: Name Reactions and Reagents in Organic Synthesus, Second Edition. John Wiley & Sons, Inc., Hoboken, New Jersey, 2005, ISBN 9780471739876, S. 84–85, doi:10.1002/9780471739876.
- ↑ T. Laue, A. Plagens: Namen- und Schlagwort-Reaktionen 4. Auflage, Teubner, Wiesbaden, 2004, ISBN 3-519-33526-3, S. 40–42.
- ↑ A. Hassner, I. Namboothiri: Organic Syntheses Based on Name Reactions A practical guide to 750 transformations, Elsevier Ltd, Amsterdam, 2012, ISBN 978-0-08-096630-4, S. 543.
Auf dieser Seite verwendete Medien
Autor/Urheber: Schmiddi98, Lizenz: CC BY-SA 4.0
Zinin-Reduktion
Ortho-Semidin
2,2'-Diaminobiphenyl
Para-Semidin
Autor/Urheber: Schmiddi98, Lizenz: CC BY-SA 4.0
2,4'-Diaminobiphenyl