Barrett-Ösophagus
| Klassifikation nach ICD-10 | |
|---|---|
| K22.1 | Barrett-Ulkus |
| K22.7 | Barrett-Ösophagus |
| ICD-10 online (WHO-Version 2019) | |
| Klassifikation nach ICD-11 | |
|---|---|
| DA23 | Metaplastisches Zylinderepithel des Ösophagus |
| DA23.0 | Barrett-Epithel |
| DA23.1 | Dysplasie des Barrett-Epithels |
| DA23.2 | Barrett-Ulkus |
| 2B70.00 | Barrett-Adenokarzinom |
| DA23.Y | Sonstiges näher bezeichnetes metaplastisches Zylinderepithel des Ösophagus |
| DA23.Z | Metaplastisches Zylinderepithel des Ösophagus, nicht näher bezeichnet |
| ICD-11: Englisch • Deutsch (Entwurf) | |
Als Barrett-Ösophagus (nach dem britischen Chirurgen Norman Rupert Barrett, der 1950 bzw. 1957 das Krankheitsbild beschrieb[1], Synonyme Barrett-Metaplasie, Endobrachyösophagus von griechisch ἔνδον innen, βραχύς kurz, οἰσοφάγος Speiseröhre) bezeichnet man eine Folge der Refluxkrankheit, bei der sich durch die chronische Reizung durch sauren Mageninhalt das Plattenepithel der unteren Speiseröhre in spezialisiertes Zylinderepithel wie im Dünndarm umwandelt (intestinale Metaplasie). Sie betrifft etwa jeden 10. Refluxkranken, in den westlichen Industriestaaten entspricht das 1–2 % der gesamten Bevölkerung. Die Umwandlung ist eine Vorstufe von Speiseröhrenkrebs, weswegen sie regelmäßig kontrolliert werden muss. Die Ausbildung eines Ulcus pepticum auf der metaplastischen Schleimhaut der Speiseröhre wird als Barrett-Syndrom oder Allison-Johnstone-Syndrom bezeichnet.
Epidemiologie
Der Barrett-Ösophagus tritt bei etwa 10 % der Reflux-Kranken auf, was heißt, dass etwa 1–2 % der Bevölkerung in westlichen Staaten betroffen sind (Prävalenz). Männer sind doppelt so häufig betroffen wie Frauen.[2] Weitere Risikofaktoren für die Entwicklung eines Barrett-Ösophagus sind Rauchen, Übergewicht, eine axiale Hernie (das heißt, der Magen rutscht zum Teil durch die Zwerchfelllücke und schließt dadurch nicht mehr richtig) und Beschwerden durch die Refluxkrankheit. Die drei letztgenannten Faktoren verstärken den Reflux bzw. sprechen für eine Schädigung der Speiseröhrenschleimhaut. Eine Besiedlung der Magenschleimhaut durch Helicobacter pylori senkt das Risiko für die Entwicklung eines Barrett-Ösophagus, da sie die Säureproduktion hemmt und daher der Magensaft die Schleimhaut der Speiseröhre weniger angreift. Ebenfalls günstigen Einfluss hat eine Ernährung mit Obst und Gemüse. Der Einfluss von Alkohol auf die Entstehung der Barrett-Metaplasie ist unklar.[3]
Pathogenese
Beim Gesunden ist die Speiseröhre innen vollständig von einem mehrschichtigen, unverhornten Plattenepithel ausgekleidet, das auf die mechanische Belastung durch vorbeigleitende Nahrung ausgelegt ist. Bei der Refluxkrankheit fließt saurer Mageninhalt vom Magen zurück in die Speiseröhre, was zu einer Schädigung des Plattenepithels und chronischen Entzündung (Refluxösophagitis) führt. Normalerweise werden die zerstörten Zellen erneut durch Plattenepithel ersetzt. Bei einigen Refluxkranken funktioniert das nicht mehr. Stattdessen bildet sich ein Zylinderepithel, das zum Schutz vor der Magensäure Schleim produziert, wie es für Magen und Dünndarm typisch ist. Diese Umwandlung von einem Gewebetyp in den anderen (Metaplasie) kennzeichnet den Barrett-Ösophagus. Sie tritt typischerweise am unteren Ende der Speiseröhre kurz vor dem Übergang in den Magen auf, weil hier die Einwirkung durch den zurückfließenden Mageninhalt am stärksten ist.[3] Woher das Zylinderepithel kommt, ist nicht geklärt; möglicherweise aktiviert die chronische Entzündung Transkriptionsfaktoren in den Plattenepithelzellen, wodurch sie sich direkt in Zylinderepithelzellen umwandeln. Oder das Zylinderepithel wird von den verschiedenen Stammzellen, die in der Schleimhaut sitzen oder dort einwandern, gebildet.[4] Die Umwandlung des Epitheltyps ist definitiv und bildet sich auch unter adäquater Behandlung des Reflux nicht oder nur teilweise zurück. Das Zylinderepithel ist zwar widerstandsfähiger gegenüber der Säure- und Pepsinbelastung, trägt dafür aber das Risiko weiterer Entartung (Dysplasie, Adenokarzinom) in sich. Außerdem neigt es zur Ulzeration (Barrett-Ulkus) und Ausbildung von Strikturen (s. Abschnitt Komplikationen).
Diagnose
Die Diagnose eines Barrett-Ösophagus wird in Kombination des endoskopischen Befundes und der mikroskopischen Untersuchung von Gewebeproben gestellt. Der Barrett-Ösophagus selbst verursacht keine Beschwerden, viele Patienten erhalten aber wegen ihrer symptomatischen Refluxösophagitis eine endoskopische Spiegelung von Speiseröhre und Magen, wobei die Veränderung dann entdeckt wird.[3]
Endoskopische Kriterien


Zur Diagnosestellung wird ein Videoendoskop verwendet, die Barrett-Metaplasie zeigt sich dabei in rötlichen Ausläufern, die in der Speiseröhrenschleimhaut vom Mageneingang aus Richtung Kopf ziehen.[5] Die Einteilung der bei der Endoskopie direkt sichtbaren Veränderungen erfolgt nach der Prag-Klassifikation. Dabei werden zwei Maße kombiniert: 1. die Länge der Veränderungen, die sich über den gesamten Umfang der Speiseröhre erstrecken (circumferenzielle Metaplasie), wird in Zentimeter zusammen mit der Bezeichnung „C“ vermerkt und 2. die zusätzlichen, meist zungenförmigen Ausläufer werden ebenfalls in Zentimeter angegeben mit der Bezeichnung „M“ für maximale Ausdehnung. Beispielsweise bedeutet ein Befund „C8M9“ eine ringförmige Metaplasie auf 8 cm und eine größte Längenausdehnung der Metaplasie von 9 cm. Gemessen wird vom gastroösophagealen Übergang aus. Man unterscheidet den kurzsegmentigen Barrett-Ösophagus (sogenannter Short-Segment-Barrett-Ösophagus) mit einer Länge bis 3 cm von dem langsegmentigen Barrett-Ösophagus (sogenannter Long-Segment-Barrett-Ösophagus) mit einer Länge über 3 cm.
Histologische Kriterien
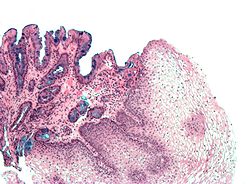
Zur weiteren Diagnosestellung werden umfangreiche Gewebeproben (Biopsien) aus den auffälligen Schleimhautstellen genommen und in der Pathologie mikroskopisch untersucht. Hier wird zum einen festgestellt, ob eine Umwandlung von Gewebe zu Zylinderepithel vorliegt und zum anderen der Nachweis bestimmter Zellen, der Becherzellen, gefordert. Diese sind typisch für das Epithel des Dünndarms, nur dann kann von einer intestinalen (von lat. Intestinum, Darm) Metaplasie gesprochen werden.[3] Selten können in einer Barrett-Metaplasie auch andere Zellen des Verdauungstraktes vorkommen, darunter Paneth-Zellen, neuroendokrine Zellen und Zellen der Bauchspeicheldrüse.[6]
Einen weiteren Punkt, der in der mikroskopischen Untersuchung zu klären ist, bildet die Klassifizierung von Gewebeschäden. Genauer geht es um die Frage, ob sich bereits ein bösartiger Tumor oder eine Vorstufe davon (Dysplasie) gebildet hat. Diese Vermehrung geschädigter Zellen wird zusammenfassend als „Neoplasie“ bezeichnet. Die Einteilung der Neoplasien erfolgt nach der Wien-Klassifikation in Gewebe ohne Dysplasie, Gewebe mit möglicher Dysplasie, Gewebe mit gut differenzierter Dysplasie (Low Grade Dysplasie), Gewebe mit schlecht differenzierter Dysplasie (High Grade Dysplasie) sowie Gewebe mit einem Adenokarzinom (nicht invasiv oder möglicherweise invasiv). Nach dieser Einteilung richtet sich die weitere Therapie.[3]
Definition
In der Wissenschaft weichen die Meinungen darüber ab, wie der Barrett-Ösophagus genau zu definieren ist. Uneinigkeit herrscht darüber, wie lang die Metaplasie mindestens sein muss, um als behandlungsbedürftiger Barrett-Ösophagus zu gelten. Einige Fachgesellschaften (darunter die Japanische Fachgesellschaft für Gastroenterologie sowie die Australische Krebsgesellschaft) fordern keine Mindestlänge, andere, wie die europäischen und britischen Fachgesellschaften, setzen eine Mindestlänge von 1 cm voraus. Der Grund für die Abweichung liegt darin, dass sehr kurzstreckige Metaplasien ein sehr geringes Entartungsrisiko haben. Außerdem sind sehr kurze Abschnitte in der Endoskopie schwerer zu beurteilen.[3] Ein weiterer Streitpunkt ist die An- oder Abwesenheit der Becherzellen, die die intestinale Metaplasie anzeigen. Zylinderepithel ohne Becherzellen ist typisch für den Magenfundus und -mund. Es ist nicht klar, ob dieses Zylinderepithel das gleiche Risiko für Speiseröhrenkrebs birgt.[4] Die meisten Fachgesellschaften fordern daher in ihren Leitlinien den Nachweis von Becherzellen, darunter auch die Deutsche Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten.[3][7]
Komplikationen
Strikturen und Ulzerationen
Eine häufige Komplikation (10 bis 24 %) ist die Bildung von Geschwüren im umgewandelten Epithel. Tatsächlich war ein solches Geschwür in der Speiseröhre Anlass für die Erstbeschreibung der Erkrankung durch den Chirurgen Norman Rupert Barrett 1950.[8] Ein solches Geschwür kann symptomlos bleiben, durch Blutungen auffallen oder im schlimmsten Fall durch die Wand der Speiseröhre in angrenzende Strukturen (wie die Aorta oder den Herzbeutel) wachsen. Bei 15 bis 40 % der Patienten bildet sich eine Verengung der Speiseröhre (Striktur) aus, meistens am Übergang von Platten- und Zylinderepithel.[9]
Karzinomentstehung
Der Barrett-Ösophagus ist vor allem wegen des Risikos der Entstehung von ösophagealen Adenokarzinomen, einer der beiden Hauptformen von Speiseröhrenkrebs, behandlungsbedürftig. Für Patienten mit Barrett-Metaplasie ohne Anzeichen einer Dysplasie liegt das jährliche Risiko für die Entwicklung eines Adenokarzinoms bei 0,1 bis 0,4 %[4][10], was ein etwas erhöhtes Risiko darstellt.[3] Die Wahrscheinlichkeit steigt deutlich, wenn eine Dysplasie vorliegt. Zahlen hierzu weichen zum Teil stark voneinander ab. Für geringgradige Dysplasien wurden jährliche Krebserkrankungsraten zwischen 1[10] sowie 5 bis 9 %[3] berichtet. Für hochgradige Dysplasien ermittelte eine Metaanalyse (eine wissenschaftlich hochwertige statistische Auswertung mehrerer Studien) ein jährliches Entartungsrisiko von 6,6 %, allerdings wurden in Therapiestudien deutlich höhere Raten von bis zu 28 % gesehen.[3] Außerdem hängt das Krebsrisiko von der Länge der Metaplasie ab (je länger, desto größer das Risiko) sowie vom biologischen Geschlecht, denn Männer mit Barrett-Ösophagus haben ein doppelt so großes Risiko wie Frauen mit Barrett-Ösophagus.[4]
Therapie
Überwachung und Intervention
Das Ziel der medizinischen Maßnahmen besteht darin, die Entstehung von Adenokarzinomen der Speiseröhre zu verhindern, die eine schlechte Prognose aufweisen. Wichtigste Maßnahme ist daher die regelmäßige Kontrolle des Befundes und die Entfernung entarteten Gewebes, wobei die genauen Empfehlungen zwischen den internationalen Fachgesellschaften variieren. In den deutschen Leitlinien wird für den Barrett-Ösophagus ohne Dysplasien eine endoskopische Kontrolle nach einem Jahr und dann alle 3 bis 4 Jahre empfohlen,[11] andere Leitlinien wie die der Europäischen Gesellschaft für gastrointestinale Endoskopie machen die Kontroll-Intervalle in diesen Fällen von der Länge des Barrett-Ösophagus abhängig.[12] Werden Dysplasien nachgewiesen, besteht die Möglichkeit (und die Empfehlung) zur endoskopischen Resektion. Mit dieser Methode wird während einer normalen endoskopischen Untersuchung der Tumor zunächst eingesaugt und dann mit einer Schlinge reseziert. Bei bösartigen Veränderungen, die tiefer in die Wandschichten der Speiseröhre einwachsen (in die Submukosa), sollte jedoch eine chirurgische Therapie (Ösophagektomie) durchgeführt werden, da in diesem Fall das Risiko einer Lymphknotenmetastasierung gegeben ist. Außerdem besteht die Möglichkeit, die Barrett-Metaplasie zu veröden. Dies wird vor allem als begleitende Therapie zur Resektion von sichtbaren Neoplasien sowie bei Vorliegen von Dysplasien empfohlen.[3][4] Am häufigsten wird dafür die Radiofrequenzablation angewandt, bei der das Gewebe mit Hitze zerstört wird. Ein wesentliches Risiko dieser Technik ist die Ausbildung von Zusammenziehungen der Speiseröhre durch Narbenstränge (Strikturen).[13] Bei Barrett-Metaplasien ohne Dysplasien wird sie daher nicht angewandt, zumal sie nicht zu einer dauerhaften Rückbildung der Metaplasie führt.[3]
Medikamentöse Therapie
Es gibt keine etablierte medikamentöse Therapie spezifisch für den Barrett-Ösophagus. Die meisten Patienten erhalten ohnehin Protonenpumpenhemmer (PPI) zur Behandlung ihrer Refluxkrankheit, wobei dies einen günstigen Effekt auf akute Entzündungen der Speiseröhre hat, sich jedoch nicht auf die weitere Entwicklung eines vorhandenen Barrett-Ösophagus auszuwirken scheint. Es gibt allerdings Hinweise darauf, dass PPI in Kombination mit Acetylsalicylsäure oder anderen NSAR tatsächlich das Krebsrisiko senken. Ähnliches wird von Statinen berichtet. Die Daten sind aber noch nicht aussagekräftig genug, als dass es offizielle Empfehlungen dazu gäbe.[3]
Historische Aspekte
Seit Anfang des 20. Jahrhunderts sind Geschwüre in der Speiseröhre bekannt, die von Zylinderepithel umgeben sind. Die genaue Zuordnung dieses Phänomens war umstritten. Der britische Chirurg Norman Barrett veröffentlichte 1950 eine Abhandlung, in der er die Organe des Verdauungstraktes über das Gewebe ihrer Innenwand definierte – das Epithel. Nach seiner Ansicht handelte es sich bei den beobachteten Veränderungen daher um versprengte Teile des Magens oder um eine rohrartige Ausziehung des Magens mit gleichzeitiger Verkürzung der Speiseröhre. Er hielt dies am ehesten für einen angeborenen Zustand. Erst 1957 änderte er seine Meinung und sah ein, dass es sich um einen von Zylinderepithel überzogenen Teil der Speiseröhre handele, der nicht dem Magen zugerechnet werden könne. In der Folgezeit setzte sich langsam „Barrett-Ösophagus“ als Bezeichnung für diesen Zustand durch. Früh fiel auf, dass die Veränderung oft gleichzeitig mit einer Zwerchfellhernie des Magens vorlag, oder dass es Zeichen einer Entzündung gab. Barrett selbst sah die Möglichkeit, dass durch den Rückfluss von Magensaft das Plattenepithel der Speiseröhre durch Zylinderepithel ersetzt wird, glaubte aber weiterhin daran, dass die Veränderung angeboren sei. Erst 1970 konnte die Verbindung zur Refluxkrankheit nachgewiesen werden. 1976 wurde erstmals der Verdacht geäußert, dass der Barrett-Ösophagus eine Vorstufe des Speiseröhrenkrebs sein könne, was in den Folgejahren bestätigt wurde.[14]
Weblinks
Literatur
- Stuart J. Spechler, Rhonda F. Souza: Barrett's Esophagus. In: New England Journal of Medicine. Band 371, Nr. 9, 28. August 2014, ISSN 0028-4793, S. 836–845, doi:10.1056/NEJMra1314704 (nejm.org).
- Yonne Peters, Ali Al-Kaabi, Nicholas J. Shaheen, Amitabh Chak, Andrew Blum: Barrett oesophagus. In: Nature Reviews Disease Primers. Band 5, Nr. 1, Dezember 2019, ISSN 2056-676X, S. 35, doi:10.1038/s41572-019-0086-z (nature.com).
Einzelnachweise
- ↑ N. R. Barrett: The lower esophagus lined by columnar epithelium. In: Surgery 1957;41, S. 881–894. PMID 13442856.
- ↑ M. B. Cook u. a.: A systematic review and meta-analysis of the sex ratio for Barrett’s esophagus, erosive reflux disease, and nonerosive reflux disease. In: Am J Epidemiol. 2005 Dec 1;162 (11), S. 1050–1061. PMID 16221805.
- ↑ a b c d e f g h i j k l m Yonne Peters, Ali Al-Kaabi, Nicholas J. Shaheen, Amitabh Chak, Andrew Blum: Barrett oesophagus. In: Nature Reviews Disease Primers. Band 5, Nr. 1, Dezember 2019, ISSN 2056-676X, S. 35, doi:10.1038/s41572-019-0086-z (nature.com [abgerufen am 21. August 2020]).
- ↑ a b c d e Stuart J. Spechler, Rhonda F. Souza: Barrett's Esophagus. In: New England Journal of Medicine. Band 371, Nr. 9, 28. August 2014, ISSN 0028-4793, S. 836–845, doi:10.1056/NEJMra1314704 (nejm.org [abgerufen am 22. August 2020]).
- ↑ Peter J. Kahrilas, Ikuo Hirano: Erkrankungen der Speiseröhre. In: Harrisons Innere Medizin, 19. Auflage in Deutscher Sprache. ABW Wissenschaftsverlag, Berlin 2016, S. 2344.
- ↑ Werner Böcker et al.: Pathologie. 5. Auflage. Urban & Fischer, München 2012, ISBN 978-3-437-42384-0, S. 551.
- ↑ DGVS: S2k-Leitlinie Refluxkrankheit, Stand 05/2014, S. 89. Zuletzt abgerufen am 22. August 2020.
- ↑ Philippe G Guillem, Henri L Porte, Alain Saudemont, Pierre A Quandalle, Alain J Wurtz: Perforation of Barrett’s ulcer: a challenge in esophageal surgery. In: The Annals of Thoracic Surgery. Band 69, Nr. 6, Juni 2000, S. 1707–1710, doi:10.1016/S0003-4975(00)01310-2 (elsevier.com [abgerufen am 23. August 2020]).
- ↑ Rao Milind: Natural history of Barrett's esophagus. In: World Journal of Gastroenterology. Band 18, Nr. 27, 2012, ISSN 1007-9327, S. 3483, doi:10.3748/wjg.v18.i27.3483, PMID 22826612, PMC 3400849 (freier Volltext) – (wjgnet.com [abgerufen am 23. August 2020]).
- ↑ a b Anil K. Rustgi, Hashem B. El-Serag: Esophageal Carcinoma. In: New England Journal of Medicine. Band 371, Nr. 26, 25. Dezember 2014, ISSN 0028-4793, S. 2499–2509, doi:10.1056/NEJMra1314530 (nejm.org [abgerufen am 23. August 2020]).
- ↑ DGVS: S2k-Leitlinie Refluxkrankheit, Stand 05/2014, S. 100. Zuletzt abgerufen am 23. August 2020.
- ↑ Bas Weusten, Raf Bisschops, Emanuel Coron, Mário Dinis-Ribeiro, Jean-Marc Dumonceau: Endoscopic management of Barrett’s esophagus: European Society of Gastrointestinal Endoscopy (ESGE) Position Statement. In: Endoscopy. Band 49, Nr. 02, 25. Januar 2017, ISSN 0013-726X, S. 191–198, doi:10.1055/s-0042-122140 (thieme-connect.de [abgerufen am 23. August 2020]).
- ↑ Prasad G. Iyer, Vivek Kaul: Barrett Esophagus. In: Mayo Clinic Proceedings. Band 94, Nr. 9, September 2019, S. 1888–1901, doi:10.1016/j.mayocp.2019.01.032 (elsevier.com [abgerufen am 24. September 2020]).
- ↑ Steven R. DeMeester, Tom R. DeMeester: Columnar Mucosa and Intestinal Metaplasia of the Esophagus: Fifty Years of Controversy. In: Annals of Surgery. Band 231, Nr. 3, März 2000, ISSN 0003-4932, S. 303–321, doi:10.1097/00000658-200003000-00003, PMID 10714623, PMC 1421001 (freier Volltext) – (lww.com [abgerufen am 24. September 2020]).
Auf dieser Seite verwendete Medien
Autor/Urheber: Jaax, Lizenz: CC BY-SA 4.0
Illustration der Prag-Klassifikation für den Barrett-Ösophagus. Hierbei wird die geringste (circumferentielle) Ausdehnung und die maximale Ausdehnung von der Grenze zwischen Speiseröhre und Magen gemessen. Die Grenze orientiert sich am Ende der Magenfalten.
Autor/Urheber: Nephron, Lizenz: CC BY-SA 3.0
Barrett's esophagus (left part of image). Alcian blue stain.
The characteristic goblet cells are stained blue.
Normal stratified squamous epithelium is seen on the right of the image.Autor/Urheber: Samir धर्म, Lizenz: Copyrighted free use
Endoscopic image of Barrett's esophagus


