BVD/MD
Die Bovine Virusdiarrhoe/Mucosal Disease, kurz BVD/MD (ausgelöst durch das Bovine-Virusdiarrhoe-Virus, BVDV), ist ein recht häufiger viraler Krankheitskomplex der Rinder, welchem aufgrund seiner Epidemiologie (sowohl „hit and run“ als auch „infect and persist“) eine Sonderstellung zukommt. Die Infektion verläuft innerhalb eines Bestandes oft zyklisch. Die Virusdiarrhoe wurde erstmals 1946 beschrieben, die Mucosal disease findet erstmals 1953 in der Literatur Erwähnung. Die gemeinsame Ursache wurde 1959 nachgewiesen. Der Krankheitskomplex ist weltweit verbreitet.
Formen
Das Virus kann mehrere Krankheitsbilder auslösen, die in Morbidität und Letalität stark voneinander abweichen. In der besonders gefährdeten Gruppe der persistent infizierten (oder PI-) Tiere betragen beide 100 Prozent.
Bovine Virusdiarrhoe
Die Bovine Virusdiarrhoe, kurz BVD, ist eine Virusinfektion der Rinder, die durch ein Pestivirus aus der Familie der Flaviviridae verursacht wird. Die BVD kommt weltweit vor und zählt zu den wirtschaftlich bedeutendsten Erkrankungen des Rindes. Kürzlich publizierte Übersichtsarbeiten zeigen, dass die weltweiten monetären BVD Produktionsverluste[1] und Ausgaben für Prävention und Interventionsmaßnahmen[2] je Rind und Land stark variieren. Das Krankheitsbild ist äußerst vielfältig.
Mucosal Disease
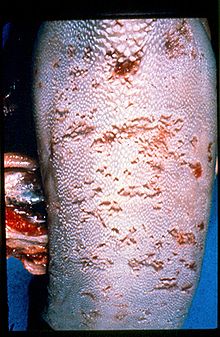
Die Mucosal Disease, kurz MD, ist eine immer tödliche Erkrankung meist junger Rinder (3 bis 24 Monate), die durch Erosionen an allen Schleimhäuten charakterisiert ist (siehe Bild). Bemerkenswert ist dabei das Ausbleiben einer Immunreaktion trotz vorhandenem Virus der zytopathischen Form.
Fruchtbarkeitsstörungen
Erfolgt die Infektion bei einem Tier im ersten oder letzten Drittel der Trächtigkeit, kann es zu schweren Fehlbildungen bzw. zum Abort der Frucht kommen. Infektionen mit der zytopathischen Form im zweiten Drittel der Trächtigkeit führt meist zu Abort oder Mumifikation.
Prävalenzen
In einer weltweiten Übersichtsstudie wurde 2018 gezeigt, dass die PI-Prävalenz von niedrig (≤0,8 % Europa, Nordamerika, Australien), mittel (>0,8 % bis 1,6 % Ostasien) bis hoch (>1,6 % Westasien) reichen. Länder die keine Interventionsmaßnahmen (inkludiert auch Impfung) implementiert hatten, hatten die höchsten BVDV-Prävalenzen.[3]
Epizootologie
Die Infektion erfolgt entweder horizontal (d. h. von einem anderen Tier) oder vertikal (d. h. schon während der Trächtigkeit vom Muttertier auf das ungeborene Kalb).
Bei einer horizontalen Infektion entwickelt das Tier nach der Ansteckung mit zytopathischem oder nicht-zytopathischem BVDV Symptome der BVD, eliminiert das Virus in einer normalen Immunreaktion unter Bildung von Antikörpern und behält eine dauerhafte Immunität (hit-and-run-Strategie).
Die vertikale Infektion kann erfolgen, wenn sich das Muttertier im ersten Drittel (circa 1–3. Trächtigkeitsmonat) der Trächtigkeit mit dem nicht-zytopathischen BVDV infiziert. Das Virus geht in diesem Fall auf den Fetus über. Da dieser sich in der Phase der Immuntoleranz befindet, erkennt sein Immunsystem das Virus nicht als fremdes Antigen. Es bildet daher keine Antikörper und das Jungtier bleibt lebenslang mit dem Virus infiziert und scheidet dieses permanent aus, ohne aber selbst Symptome zu zeigen. Solche PI-Tiere (PI steht für persistent infiziert) bilden innerhalb der Population ein Virusreservoir (infect-and-persist-Strategie).
Die Einschleppung in einen Rinderbestand kann auf unterschiedlichen Wegen erfolgen. Häufig erfolgt sie über die Einstellung persistent infizierter Tiere. Auch Infektionen beim Weidegang (gemeinsame Alpung erstträchtiger Rinder!), auf Ausstellungen und Tiermärkten kommen in Frage. Ein weiteres Risiko stellen mangelhafte hygienische Vorkehrungen dar. Hier kommen als Krankheitsvektoren kontaminierte Transportfahrzeuge, Geräte, Kleidung und Futtermittel in Frage. Das Risiko einer Übertragung durch Stechinsekten oder Schädlingen wie Ratten und Mäusen sowie eine Übertragung durch die Luft scheint hingegen gering zu sein.
Vom PI-Tier zum MD-Opfer
Das BVDV kommt wie schon erwähnt in einer zytopathischen und einer nicht zytopathischen Form vor, welche durch Mutation eines Virusgens entstanden sind. Mutiert in einem PI-Tier nun ein Virus von der nicht zytopathischen zur zytopathischen Form, vermehrt es sich in den Schleimhäuten und schädigt diese, was zu den typischen Erosionen der MD führt. Da das Immunsystem das Virus aber nicht als fremd erkennt, bleibt eine Immunreaktion aus, so dass die Krankheit immer tödlich verläuft.
Tests
Nachdem die PI-Tiere die Ansteckungsquelle bilden, müssen diese identifiziert und eliminiert werden. Zur klaren Identifikation des Status eines Tiers ist aber sowohl ein Virusnachweis als auch ein Antikörpernachweis nötig. Dabei sind folgende Ergebnisse möglich:
- Antikörper und Virus negativ: Gesundes Tier; hatte nie Kontakt mit dem Virus. Kann nicht Mutter eines PI-Tieres sein.
- Antikörper positiv, Virus negativ: Gesundes Tier; hat BVD durchgemacht. Kälber können PI-Tiere sein.
- Antikörper positiv, Virus negativ: bei Kälbern: kann ein PI-Tier in der kolostralen Lücke (maternale Antikörper der Mutter maskieren das Virus, daher ist im Bluttest das Virus erst bei älteren Tieren nachweisbar.) sein.
- Antikörper und Virus positiv: An BVD erkranktes Tier, das gerade die akute Infektion durchmacht. Wird gesund werden; falls trächtig, besteht die Gefahr eines PI-Kalbs.
- Antikörper negativ, Virus positiv: PI-Tier. Infektionsquelle für andere Tiere; wird wahrscheinlich irgendwann an MD erkranken oder ist bereits daran erkrankt. Sämtliche Nachkommen sind ebenfalls PI-Tiere.
Zur Erkennung von BVDV in einem Bestand ist neben der Blutuntersuchung auch eine serologische Untersuchung der Milch möglich.
Besondere Bedeutung kommt in der Bundesrepublik Deutschland der virologischen Untersuchung von Ohrstanzproben, die im Rahmen der amtlichen Kennzeichnung neugeborener Kälber entnommen werden, zu. Diese erfolgt im Allgemeinen mittels PCR.
Bekämpfung
In Deutschland besteht für die Erkrankung Anzeigepflicht nach dem Tiergesundheitsgesetz (TierGesG).[4] Auch in Österreich besteht Anzeigepflicht.[5]
Die Bekämpfung basiert auf zwei Säulen:
- Identifikation und Elimination von PI-Tieren
- Verhinderung der Neuansteckung von trächtigen Tieren
Es existiert eine Impfung gegen das Virus, die aber bei PI-Tieren natürlich keine Wirkung zeigt. Außerdem kann bei Anwendung der Impfung nicht mehr sicher zwischen infizierten und nicht infizierten Beständen unterschieden werden.
In der Schweiz lief zwischen 2008 und 2012 ein staatlich koordiniertes Ausrottungsprogramm. Nachdem 99,5 % der Rinderhaltungen BVD-frei war, wurde die flächendeckende virologische Untersuchung der neugeborenen Kälber eingestellt. Dennoch ist die Seuche immer noch nicht vollständig getilgt.[6] Mitte März 2019 waren 99,2 % der Betriebe BVD-frei, 49 Betriebe aufgrund eines BVD-Verdachts oder BVD-Falles gesperrt und weitere 245 Betriebe hatten einzelne trächtige Tiere im Bestand, die aufgrund von BVD vorsorglich gesperrt worden sind.[7]
In Nordrhein-Westfalen gibt es seit dem 1. Oktober 2009 ein freiwilliges Bekämpfungsverfahren. Ziel ist es, möglichst vielen Beständen den Status eines „BVD-unverdächtigen Bestandes“ erteilen zu können. Seit dem 1. Januar 2011 gilt in der Bundesrepublik Deutschland eine Sanierungspflicht. Die Rechtsgrundlage hierfür ist die BVDV-Verordnung.
Im August 2004 wurde ein nationales verpflichtendes BVD Bekämpfungsprogramm in Österreich implementiert. Hierdurch konnten die Krankheitshäufigkeiten (bedingt durch BVDV) erheblich gesenkt werden.[8]
Mit dem Inkrafttreten der Verordnung EU 2016/429 gibt es erstmals ein einheitliches Tierseuchenrecht in der EU, das in den EU-Ländern seit dem 21. April 2021 direkt anzuwenden ist. Die BVD/MD ist als optional zu tilgende Seuche in Anhang II, die Maßnahmen sind in der Durchführungsbestimmung (EU) 2018/1882 sowie in der Delegierten Verordnung (EU) 2020/689 geregelt. Die Maßnahmen zur Tilgung der BVD/MD sind nach EU-Recht flexibel, um die Erfolge der oben erwähnten nationalen Tilgungsprogramme zu bewahren. Eine Region kann den Status „frei von BVD“ beantragen, wenn 18 Monate kein BVD-Fall mehr nachgewiesen wurde und 99,8 % der Betriebe mit mindestens 99,9 % der gehaltenen Rinder BVD-frei sind. In Regionen, die „frei von BVD“ sind, dürfen keine Impfungen gegen die Erkrankung durchgeführt und auch keine geimpften Tiere mehr eingestallt werden.[9]
Wirtschaftliche Bedeutung
BVD-MD ist ein wichtiger wirtschaftlicher Faktor, der die Produktivität einer Rinderherde wesentlich reduzieren kann. Insbesondere problematisch ist dabei die gemeinsame Haltung der trächtigen Rinder auf der Alm (Bergweide), die dadurch mit hoher Wahrscheinlichkeit mit dem Virus in Kontakt kommen, angesteckt werden und in der Folge PI-Tiere gebären. Es wurde festgestellt, dass die Kosten je Milchkuh um ca. 25 US-Dollar höher lagen als bei einem fleischliefernden Rind. Faktoren, wie Mortalität, vorzeitige Schlachtungen, Aborte und Neuinfektionen beeinflussen die BVD Produktionsverluste je Tier erheblich.[10]
Literatur
- Gerrit Dirksen, Hans-Dieter Gründer, Matthaeus Stöber: Innere Medizin und Chirurgie des Rindes. Parey-Verlag, Berlin 2002, ISBN 3-8263-3181-8.
Einzelnachweise
- ↑ V. Richter, K. Lebl, W. Baumgartner, W. Obritzhauser, A. Käsbohrer, B. Pinior: A systematic worldwide review of the direct monetary losses due to bovine viral diarrhea virus infection. In: The Veterinary Journal. Band 220, 2017, S. 80–87, doi:10.1016/j.tvjl.2017.01.005, PMID 28190502.
- ↑ B. Pinior, C. Firth, V. Richter, K. Lebl, M. Trauffler, M. Dzieciol, S. Hutter, J. Burgstaller, W. Obritzhauser, P. Winter, A. Käsbohrer: A systematic review of financial and economic assessments of bovine viral diarrhea virus (BVDV) prevention and mitigation activities worldwide. In: Preventive Veterinary Medicine. Band 137, 2017, S. 77–92, doi:10.1016/j.prevetmed.2016.12.014, PMID 28040270.
- ↑ B. Scharnböck, F. Roch, V. Richter, C. Funke, C. Firth, W. Obritzhauser, W. Baumgartner, A. Käsbohrer, B. Pinior: A meta-analysis of bovine viral diarrhoea virus (BVDV) prevalences in the global cattle population. In: Scientific Reports. Band 8, 2018, S. 14420, doi:10.1038/s41598-018-32831-2.
- ↑ Verordnung über anzeigepflichtige Tierseuchen in der Fassung der Bekanntmachung vom 19. Juli 2011 (BGBl. I S. 1404), geändert durch Artikel 3 der Verordnung vom 3. Mai 2016 (BGBl. I S. 1057) in Verbindung mit § 4 des Gesetzes zur Vorbeugung vor und Bekämpfung von Tierseuchen (Tiergesundheitsgesetz - TierGesG) vom 22. Mai 2013 (BGBl. I S. 1324), zuletzt geändert durch Artikel 8 Absatz 12 des Gesetzes vom 3. Dezember 2015 (BGBl. I S. 2178)
- ↑ § 18 des IBR/IPV-Gesetzes
- ↑ BLV: BVD
- ↑ BVD-Bekämpfung im Jahr 2019. (PDF; 897 kB) In: mutterkuh.ch. Abgerufen am 21. Mai 2019.
- ↑ T. Marschik, W. Obritzhauser, P. Wagner, V. Richter, M. Mayerhofer, C. Egger-Danner, A. Käsbohrer, B. Pinior: A cost-benefit analysis and the potential trade effects of the bovine viral diarrhoea eradication programme in Syria, Austria. In: The Veterinary Journal. Band 231, 2018, S. 19–29, doi:10.1016/j.tvjl.2017.11.010, PMID 29429483.
- ↑ Yvonne Gall et al.: Das Tiergesundheitsrecht der Europäischen Union. Teil 2: Neue Regelungen zur Bekämpfung der Bovinen Virusdiarrhoe (BVD). In: Dt. TÄBl. Band 69, Heft 6, S. 680–685.
- ↑ V. Richter, K. Lebl, W. Baumgartner, W. Obritzhauser, A. Käsbohrer, B. Pinior: A systematic worldwide review of the direct monetary losses due to bovine viral diarrhea virus infection. In: The Veterinary Journal. Band 220, 2017, S. 80–87, doi:10.1016/j.tvjl.2017.01.005, PMID 28190502.
Auf dieser Seite verwendete Medien
Autor/Urheber: Lucien Mahin, Lizenz: CC BY-SA 3.0
tongue lesions on confirmed BVD/MD case (mucosal disease form); case published by MAHIN, L., CHADLI, M., HAMIDI, M., WELLEMANS, G. in 1982 in Zentralblat für Veterinärmedizin B, 29 , 789-793 under title : "Clinical Bovine Virus Diarrhoea in Morocco: first report."
