Avermectine

Als Avermectine wird eine Gruppe von Neurotoxinen bezeichnet, die als Endprodukte der Fermentation des Bakteriums Streptomyces avermitilis entstehen. In manchen Fällen werden die Fermentationsprodukte anschließend chemisch behandelt; dabei entstehen sogenannte halbsynthetische Avermectine.
Für ihre Entdeckung erhielten William C. Campbell und Satoshi Ōmura den Nobelpreis für Physiologie oder Medizin des Jahres 2015.
Chemie und Vertreter
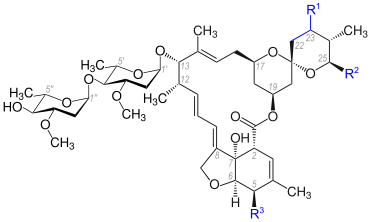
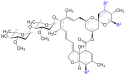
Chemisch gesehen sind die Avermectine Makrolide, d. h. makrocyclische Verbindungen aus der Gruppe der Lactone, zu denen auch die Derivate Ivermectin, Selamectin, Doramectin und Abamectin zählen.
Folgende Varianten des Avermectins sind beschrieben:[1]
Anwendung und Wirkungsweise
Avermectine werden bei der Parasitenbekämpfung von Haus- und Nutztieren sowie prophylaktisch bei Nutzpflanzen gegen Milbenbefall[2] und seit Mai 2015 auch bei erwachsenen Menschen gegen die Hautkrankheit Rosazea verwendet.[3] Sie zeigen eine breite Wirksamkeit gegen Nematoden und Milben. Sinnvolle Dosen bewegen sich bei Tieren im Bereich von 300 μg pro kg Körpergewicht oder darunter; für Pflanzenapplikation wird eine 2%ige wässrige Emulsion eingesetzt. Anders als die meisten weiteren Makrolide zeigen Avermectine keine antibakterielle oder fungizide Wirkung.[4]
Die Avermectin-Neurotoxine erhöhen bei Wirbellosen die Membrandurchlässigkeit der Nerven- bzw. der Muskelzellen für Chlorid-Ionen durch Bindung an Glutamat-aktivierte Chloridkanäle. Dadurch kommt es zur Hyperpolarisation der Zellmembran und zu einer Blockierung der Erregungsüberleitung und damit Lähmung der Parasiten. Daneben beeinflussen Avermectine in höherer Dosierung auch die Rezeptoren für γ-Aminobuttersäure (GABA) in Synapsen, die GABA als Neurotransmitter nutzen.[5] Durch erhöhte Ausschüttung von GABA werden die betroffenen Schädlinge paralysiert und sterben.
Da GABA auch im Gehirn von Wirbeltieren vorkommt, können diese Wirkstoffe Nebenwirkungen und toxische Effekte auslösen, die sich in einer Abgeschlagenheit äußern. Vor allem Vögel (hier vor allem Finken und Wellensittiche) sowie Ratten und Tiere mit MDR1-Defekt reagieren relativ empfindlich auf Avermectine.[6] Bei den meisten Säugetieren durchdringen Avermectine jedoch nicht die Blut-Hirn-Schranke, wodurch diese geschützt sind.[5]
Weblinks
- Eintrag zu Avermectine bei Vetpharm, abgerufen am 11. August 2012.
Einzelnachweise
- ↑ K. Hardtke et al. (Hrsg.): Kommentar zum Europäischen Arzneibuch Ph. Eur. 5.0, Ivermectin. Loseblattsammlung, 19. Lieferung 2005, Wissenschaftliche Verlagsgesellschaft Stuttgart.
- ↑ Atanas Georgiev Dimitrov (2005): Integrierte Produktion von Tomaten …, S. 42, Tenea Verlag Ltd., ISBN 3-86504-116-7.
- ↑ Ivermectin: Ein Insektizid gegen Rosacea, Pharmazeutische Zeitung vom 12. Mai 2015, abgerufen am 3. Januar 2016.
- ↑ Hotson, I.K. (1982): The avermectins: A new family of antiparasitic agents. In: J. S. Afr. Vet. Assoc. Bd. 53, S. 87–90, PMID 6750121.
- ↑ a b Campbell, W.C. et al. (1983): Ivermectin: a potent new antiparasitic agent. In: Science. Bd. 221, S. 823–828, PMID 6308762.
- ↑ D.C. Plumb: Veterinary Drug Handbook. PharmaVet Publishing, White Bear Lake (USA) 199, ISBN 0-9626619-0-2.
Auf dieser Seite verwendete Medien
Autor/Urheber: Benff, Lizenz: CC BY-SA 4.0
Grundstruktur der Avermectine
Struktur von Doramectin