Avanafil
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
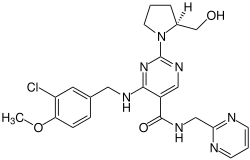 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Freiname | Avanafil | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C23H26ClN7O3 | |||||||||||||||
| Kurzbeschreibung | farbloser bis beiger Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||
| ATC-Code | G04BE10 | |||||||||||||||
| Wirkstoffklasse | ||||||||||||||||
| Wirkmechanismus | ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 483,951 g·mol−1 | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Avanafil ist ein Arzneistoff aus der Gruppe der PDE-5-Hemmer, der in der Behandlung der erektilen Dysfunktion eingesetzt wird.
Klinische Angaben
Anwendungsgebiete
Avanafil wird zur Behandlung der erektilen Dysfunktion bei erwachsenen Männern eingesetzt. Die empfohlene Dosis von Avanafil beträgt 100 mg und wird bei Bedarf etwa 30 Minuten vor der sexuellen Aktivität eingenommen. Einige Studien konnten zeigen, dass die Wirkung von Avanafil bereits innerhalb von 15 Minuten einsetzt und über 6 Stunden andauern kann.[2][3][4][5]
Für die Wirkung von PDE-5-Hemmern ist eine sexuelle Erregung notwendig. Je nach individueller Wirksamkeit und Verträglichkeit kann die Dosis auf maximal 200 mg erhöht oder auf 50 mg reduziert werden. Im Vergleich zu anderen PDE-5-Hemmern konnte eine höhere Selektivität von Avanafil für die Phosphodiesterase-5 (PDE-5) gezeigt werden, was eine bessere Verträglichkeit zur Folge hat.[6]
Gegenanzeigen
Bei Männern mit Herzerkrankungen muss der behandelnde Arzt vor dem Verschreiben von Avanafil das mögliche Risiko sexueller Aktivität für das Herz bedenken. Das Arzneimittel darf bei Patienten mit bestimmten schweren Herz- oder Kreislaufproblemen nicht angewendet werden, Patienten eingeschlossen, die innerhalb der letzten sechs Monate einen Herzinfarkt, einen Schlaganfall oder schwere Arrhythmien (unregelmäßiger Herzschlag) erlitten oder an instabiler Angina (einer bestimmten Art von starken Brustschmerzen), Angina während des Geschlechtsverkehrs, Herzversagen oder hohem oder niedrigem Blutdruck leiden. Avanafil darf auch nicht bei Patienten angewendet werden, deren Leber- oder Nierenfunktion stark beeinträchtigt ist oder die aufgrund einer Störung des Blutstroms zum Sehnerv (nichtarteriitische anteriore ischämische Optikusneuropathie, NAION) einen Sehverlust erlitten haben, der durch diese Klasse von Arzneimitteln ausgelöst werden kann.[7]
Wechselwirkungen mit anderen Medikamenten
Avanafil darf nicht mit bestimmten anderen Arzneimitteln wie Nitraten (eine bestimmte Art von Arzneimitteln gegen Angina Pectoris), oder der Sex-Droge "Poppers" (in der MSM-Szene auch bekannt unter der Abkürzung "PP") eingenommen werden, da diese ebenfalls Nitrate enthalten die in Kombination mit Avanafil aber auch in Kombination mit allen anderen PDE-5-Inhibitoren zu einem lebensbedrohlichen Blutdruckabfall, und in der Folge zum Herzstillstand führen können. Vorsicht geboten ist auch bei den Inhibitoren des Cytochrom CYP3A4 (aus der Cytochrom-P450-Familie) die den Metabolismus von Avanafil im Körper stark reduzieren und darüber hinaus zu einem starken Anstieg des Avanafil-Spiegels im Blut führen und damit einhergehend zum Auftreten von unerwünschten Nebenwirkungen führen können bzw. Nebenwirkungen deutlich verstärken können. Zu den Inhibitoren von Cytochrom CYP3A4 zählen unter anderem: Ketoconazol, Ritonavir, Cobicistat, Atazanavir, Clarithromycin, Indinavir, Itraconazol, Nefazodon, Nelfinavir, Saquinavir und Telithromycin (...Auflistung nicht abschließend).[8] Ist eine Behandlung mit den zuvor genannten Arzneien oder einem Medikament aus der Gruppe der Protease-Inhibitoren (PI) (eine Wirkstoffklasse aus der HIV-Therapie) erforderlich so ist eine Dosisanpassung unbedingt zu beachten. Die Anfangsdosis von 100 mg / 48 Stunden sollte in diesem Fall nicht überschritten werden.
Unerwünschte Wirkungen
Avanafil hat keine sehr häufigen (>1/10) Nebenwirkungen. Häufige Nebenwirkungen (>1/100 bis <1/10) von Avanafil sind Kopfschmerzen, Flush (Erröten) und verstopfte Nase. Die vollständige Auflistung der im Zusammenhang mit Avanafil berichteten Nebenwirkungen ist der Packungsbeilage zu entnehmen.[7]
Pharmakologische Eigenschaften
Wirkungsmechanismus
Eine Erektion entsteht durch das Zusammenspiel von zwei körpereigenen Substanzen: cyclisches Guanosinmonophosphat (cGMP) und Phosphodiesterase Typ 5 (PDE-5). cGMP sorgt für eine Erschlaffung der glatten Muskelzellen im Schwellkörper des Penis und damit zu einem verstärkten Blutzustrom. Dies führt zur Erektion. Phosphodiesterase Typ 5 (PDE-5) hingegen sorgt dafür, dass cGMP abgebaut wird, was zum Abklingen der Erektion führt. Avanafil ist ein höchst selektiver und reversibler Hemmstoff der (cGMP)-spezifischen PDE-5. Das bedeutet, dass Avanafil PDE-5 hemmt und somit das für die Erektion notwendige cGMP nicht abgebaut wird. Die Konzentration des cGMP steigt an und es kommt zur Erektion, die ausreichend lange aufrechterhalten werden kann, um die sexuelle Aktivität zufriedenstellend durchzuführen. Für die Entstehung einer Erektion ist auch bei Einnahme von Avanafil eine sexuelle Stimulation Voraussetzung.[7]
Aufnahme und Verteilung im Körper
Avanafil zeichnet sich durch einen raschen Wirkeintritt aus. Es sollte etwa 30 Minuten vor Beginn der sexuellen Aktivität eingenommen werden. Die empfohlene maximale Einnahmehäufigkeit ist einmal täglich. Die Wirkung von Avanafil kann bereits innerhalb von 15 Minuten einsetzen und länger als 6 Stunden andauern.[9]
Erstattungsfähigkeit
In Deutschland übernehmen die Krankenkassen die Kosten für Avanafil nicht und Patienten müssen für die Therapie, genau wie bei anderen PDE-5-Hemmern, selbst aufkommen. Seit dem 1. Januar 2004 schließt das GKV-Modernisierungsgesetz vom 14. November 2003 (BGBl. I S. 2190) in § 34 Abs. 1 Satz 7 und 8 SGB V die Arzneimittel aus, bei deren Anwendung eine Erhöhung der Lebensqualität im Vordergrund steht. Dazu zählen u. a. Arzneimittel, die überwiegend zur Behandlung der erektilen Dysfunktion oder der Anreizung sowie Steigerung der sexuellen Potenz dienen. Die Ursache der Störung ist unerheblich. Eine Ausnahmeregelung ist nicht vorgesehen.
Handelsnamen
Avanafil ist seit dem 21. Juni 2013 unter dem Namen Spedra (Menarini) in der EU zugelassen[10][7] und seit April 2014 in Tabletten-Form in den Dosisstärken 50 mg, 100 mg und 200 mg auf Verschreibung erhältlich.[11][12][13] Das Präparat wurde von Vivus Inc. (Eigenschreibweise VIVUS) zur Zulassungsreife gebracht und wird in Deutschland durch die Berlin-Chemie AG (Menarini) vertrieben.[14]
Die US-amerikanische Arzneibehörde FDA hat Avanafil Ende April 2012 zugelassen; der Handelsname in den USA lautet Stendra.[9]
Literatur
- M. Sanford: Avanafil: a review of its use in patients with erectile dysfunction. In: Drugs & aging. Band 30, Nummer 10, Oktober 2013, S. 853–862, doi:10.1007/s40266-013-0112-x. PMID 23955441 (Review).
- C. Zhao, S. W. Kim u. a.: Efficacy and safety of avanafil for treating erectile dysfunction: results of a multicentre, randomized, double-blind, placebo-controlled trial. In: BJU international. Band 110, Nummer 11, Dezember 2012, S. 1801–1806, doi:10.1111/j.1464-410X.2012.11095.x. PMID 22448738.
Einzelnachweise
- ↑ a b c Datenblatt Avanafil 98% (HPLC) bei Sigma-Aldrich, abgerufen am 1. Januar 2024 (PDF).
- ↑ L. H. Belkoff u. a.: An open-label, long-term evaluation of the safety, efficacy and tolerability of avanafil in male patients with mild to severe erectile dysfunction. In: Int J Clin Pract. 67, April 2013, S. 333–341. doi:10.1111/ijcp.12065. PMID 23521325.
- ↑ I. Goldstein, A. R. McCullough, L. A. Jones u. a.: A randomized, double-blind, placebo-controlled evaluation of the safety and efficacy of avanafil in subjects with erectile dysfunction. In: J Sex Med. 9, 2012, S. 1122–1133. doi:10.1111/j.1743-6109.2011.02629.x. PMID 22248153.
- ↑ I. Goldstein, L. A. Jones, L. Belkoff u. a.: Avanafil for the treatment of erectile dysfunction: a multicenter, randomized, double-blind study in men with diabetes mellitus. In: Mayo Clin Proc. 87(9), August 2012, S. 843–852. doi:10.1016/j.mayocp.2012.06.016. PMID 22857780.
- ↑ J. P. Mulhall, A. L. Burnett, R. Wang u. a.: A phase 3, placebo controlled study of the safety and efficacy of avanafil for the treatment of erectile dysfunction after nerve sparing radical prostatectomy. In: J Urol. 189, 2013, S. 2229–2236. doi:10.1016/j.juro.2012.11.177. PMID 23219537.
- ↑ R. Wang u. a.: Selectivity of avanafil, a PDE5 inhibitor for the treatment of erectile dysfunction: implications for clinical safety and improved tolerability. In: J Sex Med. 9, August 2012, S. 2122–2129. doi:10.1111/j.1743-6109.2012.02822.x. PMID 22759639.
- ↑ a b c d Zusammenfassung des EPAR für die Öffentlichkeit (deutsch), Website der europäischen Gesundheitsbehörde (EMA), abgerufen am 21. Februar 2014 (PDF; 81 kB).
- ↑ Avoxa Mediengruppe Deutscher Apotheker GmbH: Tadalafil und Vardenafil. In: Pharmazeutische Zeitung online. Abgerufen am 22. Juli 2017.
- ↑ a b Erektile Dysfunktion - Neuer PDE5-Hemmer Avanafil. Website der Deutschen Apotheker Zeitung (DAZ), abgerufen am 21. Februar 2014.
- ↑ European public assessment report (EPAR) for Spedra - Avanafil (engl.) ( vom 1. April 2014 im Internet Archive), Website der europäischen Gesundheitsbehörde (EMA), abgerufen am 21. Februar 2014.
- ↑ Information für Patienten ( vom 23. September 2015 im Internet Archive) Gebrauchsinformation Spedra® (200 mg).
- ↑ Information für Patienten ( vom 23. September 2015 im Internet Archive) Gebrauchsinformation Spedra® (50 mg).
- ↑ 1500 Sexualmediziner aus über 70 Ländern tagten in Istanbul, Bild.de vom 2. Februar 2014, abgerufen am 21. Februar 2014.
- ↑ VIVUS Announces Avanafil Partnership With Menarini ( vom 8. Dezember 2015 im Internet Archive), Pressemeldung der Vivus Inc. vom 9. Juli 2013, abgerufen am 21. Februar 2014.
Auf dieser Seite verwendete Medien
Strukturformel von Avanafil
