Auxiliar
Ein Auxiliar (lat. auxiliari = helfen) bezeichnet in der Chemie eine kovalent an ein Molekül angebrachte Gruppe, die eine spezielle Reaktion ermöglicht oder deren stereochemischen Verlauf beeinflusst. Nach erfolgreicher Reaktion kann das Auxiliar in einem weiteren Schritt wieder abgespalten werden.
Chirale Auxiliare
Mit Hilfe eines chiralen Auxiliars kann der Verlauf einer an und für sich nicht stereoselektiven chemischen Reaktion so gesteuert werden, dass nach Abspaltung des Auxiliars dennoch bevorzugt ein Enantiomer erhalten wird. Das bekannteste Beispiel eines chiralen Auxiliars ist das Evans-Auxiliar, das in der Evans-Synthese enantiomerenreiner α-alkylierter Carbonsäurederivate verwendet wird. Chirale Auxiliare sind die wichtigsten in der organischen Synthese verwendeten Auxiliare.
Die Funktionsweise eines Auxiliars beruht darauf, dass durch Anbringen einer chiralen Gruppe eine stereochemische Information in das Molekül gebracht wird. Dadurch sind mögliche Angriffe auf dieses Molekül immer diastereoselektiv, die beiden Produkte der Reaktion sind also Diastereomere. Durch sterische Wechselwirkung (beispielsweise Abschirmung einer Seite des Moleküls durch einen großen Substituenten am Auxiliar) wird bevorzugt ein Diastereomer gebildet. Nach Abspaltung des Auxiliars werden die Diastereomere durch Verlust des stereogenen Zentrums am Auxiliar in die Enantiomere überführt.
Der Vorteil bei der Verwendung von chiralen Auxiliaren besteht im relativ einfachen Zugang aus dem chiral pool. Die heute bekannten und allgemein verwendeten Auxiliare sind gut erprobt und ergeben zumeist sehr gute Stereoselektivitäten. Nachteilig ist, dass die stereochemische Information im Gegensatz zur stereoselektiven Katalyse stöchiometrisch verwendet werden muss und das Auxiliar nach der Abspaltung auch oft nicht wiedergewonnen werden kann. Die Atomökonomie bei der Verwendung eines Auxiliars in einer Reaktionssequenz ist also in der Regel mäßig.
Evans-Auxiliare
Struktur
Evans-Auxiliare sind Oxazolidinone. Das Auxiliar 2 stammt vom Valin ab. Am häufigsten werden heute die benzylsubstituierten Auxiliare 3 und 4 verwendet, die aus Phenylalanin zugänglich sind. Sie sind nach ihrem Entdecker David Evans benannt.
Synthese
Evans-Auxiliare leiten sich von Aminosäuren ab. Diese werden zuerst zum Aminoalkohol reduziert und anschließend zum Oxazolidinon kondensiert.
Verwendung
Ohne die Verwendung eines Auxiliars erfolgt der Angriff eines Elektrophils (im Beispiel Methyliodid) auf das Enolat (aus dem Methyl-Ester durch Deprotonierung mit LDA erzeugt) unselektiv von beiden Seiten der Doppelbindung, wodurch beide Enantiomere im gleichen Verhältnis (ee = 0 %) gebildet werden.
Bringt man jedoch statt des Methylesters das Evans-Auxiliar (ein chirales Oxazolidinon, das über eine Amid-Bindung an das Molekül gebunden wird) an, erfolgt der Angriff von der sterisch weniger gehinderten Seite des Moleküls. Durch das Stereozentrum im Auxiliar verläuft die Reaktion jetzt diastereoselektiv. Die beiden möglichen Produkte der Alkylierung (Angriff von oben und unten) erzeugen zwei Diastereomere, die ggf. auch getrennt werden können. Erst nach Abspaltung des Auxiliars (hier mit LiOH/H2O2) erhält man das gewünschte Produkt enantiomerenrein.
Enders-Reagenz
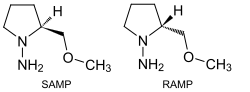
Als Enders-Reagenz werden (S)-1-Amino-2-(methoxymethyl)pyrrolidin und (R)-1-Amino-2-(methoxymethyl)pyrrolidin (SAMP und RAMP) bezeichnet. Sie sind vom Prolin abgeleitete Auxiliare, die zur stereoselektiven Alkylierung von Aldehyden verwendet werden können (so genanntes RAMP- bzw. SAMP-Verfahren).
Weitere Auxiliare
8-Phenylmenthyl-Auxiliar: Zur Auxiliar-induzierten Diastereoselektivität in konjugaten Additionen von Cupraten.
2,5-Dimethylpyrrolidin wird unter anderem als Auxiliar für intermolekulare Radikaladditionen an Acrylsäurederivate verwendet.
Literatur
- D. A. Evans, Studies in Asymmetric Synthesis - The Development of Practical Chiral Enolate Synthons In: Aldrichimica Acta. Bd. 15, 1982, S. 23.
- R. Brückner, Reaktionsmechanismen. Elsevier, Heidelberg 2004, ISBN 978-3-8274-1579-0.
- Key Chiral Auxiliary Applications. (Second Edition)(ed.: G. Roos), Academic Press, Boston, 2014, ISBN 978-0-12-417034-6.
Weblinks
Auf dieser Seite verwendete Medien
Struktur des 2,5-Dimethylpyrrolidin-Auxiliars
Elektrophile Substitution ohne Evans-Auxiliar
Elektrophile Substitution mit Evans-Auxiliar
Struktur von SAMP und RAMP
Synthese von Evans-Auxiliaren
Struktur einiger Evans-Auxiliare
Struktur des 8-Phenylmenthyl-Auxiliar












