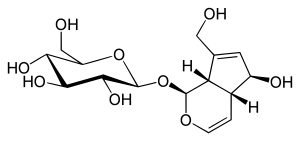
Aucubin
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Aucubin | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C15H22O9 | ||||||||||||||||||
| Kurzbeschreibung | farbloser Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 346,33 g·mol−1 | ||||||||||||||||||
| Aggregatzustand | fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit | teilweise wasserlöslich[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Aucubin ist ein häufiger sekundärer Pflanzenstoff aus der Gruppe der Iridoidglycoside. Es ist ein Glykosid des Aglykons Aucubigenin mit einer Einheit Glucose.
Struktur
Wie andere Monoterpene wird das Aglykon Aucubigenin aus zwei Isopreneinheiten mit je fünf Kohlenstoffatomen in der Pflanze synthetisiert. Im Gegensatz zu dem C10-Grundkörper der Iridoide besitzt das Aucubingrundgerüst nur neun Kohlenstoffatome, da die an den Dihydropyran-Ring gebundene Methylgruppe (C11) während der Biosynthese zu einer Carbonsäuregruppe oxidiert und dann als Kohlenstoffdioxid abgespaltet wird.[3] Die Kohlenstoffatome C6 und C10 sind jeweils durch eine Hydroxygruppe substituiert und zwischen den Kohlenstoffatomen C7 und C8 liegt eine C=C-Doppelbindung vor. Diese C=C-Doppelbindung des Cyclopentenrings ist beim verwandten Catalpol epoxidiert. Die Glucose liegt als β-D-glucopyranose vor. Die Struktur des Aucubins und seines Aglykons Aucubigenin wurden jeweils durch Einkristall-Röntgenstrukturanalysen belegt.[4]
Vorkommen

Aucubin kommt in mehrere Pflanzenarten vor und wurde zum ersten Mal 1905 von Bourquelot & Hérissey aus den Blättern der Japanischen Aukube (Aucuba japonica) isoliert. Vom Gattungsnamen Aucuba der Japanischen Aukube stammt auch der Name des Aucubins.[5][6] Die Verbindung kommt weiter u. a. auch im Spitzwegerich (Plantago lanceolata)[6][7], im Gemeinen Augentrost (Euphrasia officinalis)[7], in Arten der Gattung der Königskerzen (Verbascum), z. B. in der Großblütigen Königskerze (Verbascum densiflorum)[7] und im Echten Ehrenpreis (Veronica officinalis)[7] vor. Dabei kommt Aucubin z. B. in den Blättern[6] und Samen[5][6] der Japanischen Aukube und den Blättern des Spitzwegerichs[6] auch in relativ größeren Mengen vor.
Verwendung
Aucubin wirkt antibiotisch und beeinflusst den Blutdruck.[8] Der Saft von Spitzwegerich enthält Aucubin und schimmelt nicht. Die Säfte der meisten anderen Pflanzen schimmeln. Aucubin wirkt entzündungshemmend und reizmildernd. Durch Auflegen von zerdrückten Spitzwegerichblättern können das Jucken und die Schwellung von Insektenstichen gemildert werden. Das Aucubin bleibt jedoch nur bei sehr sorgfältiger Extraktion erhalten. Spitzwegerichtee hat das Aucubin oft durch unsachgemäße Trocknung oder Aufbewahrung verloren. Aucubin macht den Tee bitter. Da es von Darmbakterien zersetzt wird, ist es im Tee ohne pharmakologische Wirkung.
Literatur
- R. Hänsel, O. Sticher: Pharmakognosie, Phytopharmazie, 8. Auflage, Springer Verlag, Berlin 2007, ISBN 3-540-34256-7.
- J. Falbe, M. Regitz: Römp Chemie Lexikon Bd. 1, 9. Auflage, Georg Thieme Verlag 1995, ISBN 3-13-102759-2
- Ruprecht Düll, Herfried Kutzelnigg: Taschenlexikon der Pflanzen Deutschlands. Ein botanisch-ökologischer Exkursionsbegleiter zu den wichtigsten Arten. 6., völlig neu bearbeitete Auflage. Quelle & Meyer, Wiebelsheim 2005, ISBN 3-494-01397-7.
Einzelnachweise
- ↑ a b c d Datenblatt Aucubin bei Sigma-Aldrich, abgerufen am 7. Februar 2019 (PDF).
- ↑ INDOFINE Chemical Company: AUCUBIN with HPLC | 479-98-1 | INDOFINE Chemical Company, abgerufen am 28. Juni 2019
- ↑ Sampaio-Santos, M. I., Kaplan, M. A. C.: Biosynthesis significance of iridoids in chemosystematics, Journal of the Brazilian Chemical Society, 2001, 12, S. 144–153, doi:10.1590/S0103-50532001000200004
- ↑ Li, Y., Zhao, Y., Zhang, Y. M., Wang, M. J., Sun, W. J.: X-ray crystal structure of iridoid glucoside aucubin and its aglycone, Carbohydrate research, 2009, 344(16), S. 2270–2273, doi:10.1016/j.carres.2009.08.021
- ↑ a b Bourquelot, E., Hérissey, H.: Sur l'aucubine, glucoside de l' "Aucuba japonica L.", Ann. Chim. et Phys. Ser, 1905, 8(4), S. 289–318.
- ↑ a b c d e Trim, A. R., Hill, R.: The preparation and properties of aucubin, asperuloside and some related glycosides, Biochemical journal, (1952), 50(3), S. 310–319, doi:10.1042/bj0500310.
- ↑ a b c d C. Jänicke, J. Grünwald, T. Brendler: Handbuch Phytotherapie, Wissenschaftliche Verlagsgesellschaft mbH, Stuttgart 2003, S. 33–34 (Augentrost), S. 125–126 (Ehrenpreis), S. 300–301 (Königskerze), S. 504–505 (Spitzwegerich), ISBN 3-8047-1950-3
- ↑ Qing-Qing Wu, Yang Xiao u. a.: Aucubin protects against pressure overload-induced cardiac remodelling the β -adrenoceptor-neuronal NOS cascades . In: British Journal of Pharmacology. 175, 2018, S. 1548, doi:10.1111/bph.14164.
Auf dieser Seite verwendete Medien
iridoid ring numbering
Autor/Urheber: Kurt Stüber [1], Lizenz: CC BY-SA 3.0
Species: Veronica officinalis
Family: Scrophulariaceae
Aucubin


