Asiatischer Elefant
| Asiatischer Elefant | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
 Asiatischer Elefant (Elephas maximus) | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name der Gattung | ||||||||||||
| Elephas | ||||||||||||
| Linnaeus, 1758 | ||||||||||||
| Wissenschaftlicher Name der Art | ||||||||||||
| Elephas maximus | ||||||||||||
| Linnaeus, 1758 |
Der Asiatische Elefant (Elephas maximus) ist eine Art aus der Familie der Elefanten und nach dem Afrikanischen Elefanten das zweitgrößte Landtier der Erde. Wie sein afrikanischer Vetter zeichnet er sich durch den Rüssel, die (kleineren) Stoßzähne, die säulenförmigen Beine und die allgemeine Körpergröße aus. Beide unterscheiden sich aber in der Größe der Ohren, der etwas anders verlaufenden Rückenlinie und in zahlreichen anatomischen Einzelmerkmalen. Das Verbreitungsgebiet des Asiatischen Elefanten umfasst Südasien, Südostasien einschließlich Teilen der Malaiischen Inselwelt und das südliche Ostasien. Es war einst aber deutlich größer. Die Tiere bewohnen verschiedene Waldlandschaften und Offenlandgebiete vom Meeresspiegelniveau bis in höhere Gebirgslagen.
Die Lebensweise des Asiatischen Elefanten ist durch zahlreiche Studien gut erforscht, aber noch nicht so detailreich herausgearbeitet wie beim Afrikanischen Elefanten. Das Sozialgefüge zeigt einen komplexen Aufbau. Die engsten Verbindungen bestehen zwischen Mutter- und Jungtieren. Mehrere dieser Gruppen formen eine Herde oder einen Familienverband aus untereinander verwandten Tieren. Die einzelnen Tiere bilden häufig kurzfristige Partnerschaften, die aber durch vielfaches erneutes Zusammenkommen einen stabilen Charakter aufweisen. Die Hierarchie innerhalb der Familiengruppe ist eher flach, eine dominante Leitkuh wie beim Afrikanischen Elefanten spielt eine untergeordnete Rolle. Die einzelnen Herden nutzen Aktionsräume, deren Größe von den jeweiligen landschaftlichen Gegebenheiten und den Nahrungsressourcen abhängt. Die Kommunikation untereinander erfolgt auf verschiedene Weisen, etwa mit Lautgebungen im niedrigen Frequenzbereich, mit zahlreichen chemischen Signalgebern und durch Berührungen überwiegend mit dem Rüssel. Ähnlich wie der Afrikanische besitzt auch der Asiatische Elefant hohe kognitive Fähigkeiten bis hin zur Selbstwahrnehmung.
Die Nahrung umfasst weiche und harte Pflanzenkost mit regionalen und jahreszeitlichen Variationen. Härtere Pflanzennahrung überwiegt meist in der Regen-, weichere in der Trockenzeit. Die Größe der Tiere bedingt, dass ein Individuum den Großteil seiner Tagesaktivität für die Nahrungsaufnahme investiert. Die Fortpflanzung findet zumeist ganzjährig statt, sie kann aber in stärker jahreszeitlich beeinflussten Landschaftsräumen auch eingeschränkt sein. Für Bullen ist die jährlich auftretende Musth charakteristisch, die mit einer erhöhten Aggressivität einhergeht. Während dieser Phase kann es zu Rivalenkämpfen kommen. Kühe weisen einen langen Brunftzyklus mit einem für Säugetiere untypischen Verlauf auf. In der Regel wird nach rund zweijähriger Tragzeit ein Kalb geboren, das in der mütterlichen Gruppe aufwächst. Für die Dauer der Aufzucht setzt die Brunft bei der Kuh aus. Der weibliche Nachwuchs verbleibt in der Familiengruppe, der männliche verlässt diese und zieht seiner eigenen Wege.
Der Asiatische Elefant bewirkte einen starken kulturellen Einfluss in der Geschichte des Menschen. Die Zähmung geht möglicherweise bis in das dritte vorchristliche Jahrtausend zurück. Die Tiere wurden unter anderem zu Baumaßnahmen, im Kriegsdienst, als Tempelelefanten oder zu repräsentativen Zwecken eingesetzt. Mit wildlebenden Elefanten kommt es allerdings jährlich zu zahlreichen Mensch-Tier-Konflikten. Die wissenschaftliche Erstbeschreibung datiert in das Jahr 1758. Im Laufe der Zeit wurden mehrere Unterarten eingeführt, die aus genetischer Sicht aber keinen Bestand haben. Vielmehr lassen sich zwei genetisch getrennte Gruppen unterscheiden, beide teilen sich nahezu das gesamte Verbreitungsgebiet. Frühe fossile Nachweise des Asiatischen Elefanten reichen bis in das Mittlere und Obere Pleistozän zurück, sind aber insgesamt selten. Der Bestand der Art gilt als stark gefährdet und ist vor allem durch Landschaftszerstörung und Wilderei im Rückgang begriffen.
Merkmale
Habitus


Der Asiatische Elefant ist nach dem Afrikanischen Elefanten (Loxodonta africana) das zweitgrößte heute lebende Landsäugetier der Erde. Wie sein afrikanischer Verwandter können die Tiere anhand des Rüssels, der Stoßzähne und der säulenförmigen Beine gut erkannt werden. Die Kopf-Rumpf-Länge beträgt bei ausgewachsenen Exemplaren etwa 550 bis 640 cm, hinzu kommt ein 120 bis 150 cm langer Schwanz. Männliche Individuen werden mit einer Schulterhöhe von durchschnittlich 270 cm und maximal 340 cm sowie einem Gewicht von rund 3600 kg und maximal 6000 kg deutlich größer als weibliche. Bei diesen betragen die Maße der Schulterhöhe im Mittel 240 cm (im Maximum über 250 cm) und das Gewicht im Mittel 2720 kg (im Maximum 4160 kg). Die meisten Analysen zu den Größenwerten des Asiatischen Elefanten stammen von Tieren aus Indien, die aber dazu tendieren, größer zu sein als Populationen weiter östlich.[1] Aus den 1940er Jahren liegen Angaben zu einzelnen Individuen mit Höhen zwischen 323 und 343 cm vor (letzterer Wert bezieht sich auf ein Skelett).[2] Der Asiatische Elefant von der Insel Borneo ist dagegen durchschnittlich etwa einen halben Meter kleiner. Im Unterschied zum Afrikanischen Elefanten verläuft der Rücken des Asiatischen Elefanten gewölbt oder gerade, der höchste Punkt des Körpers findet sich oben auf dem Kopf und nicht auf der Schulter. Der Kopf ist gestaucht, auf der Stirn erheben sich zwei markante Buckel. Die Rüsselspitze weist nur eine fingerartige Verlängerung auf statt zwei beim Afrikanischen Elefanten. Ein auffälliges Unterscheidungsmerkmal zu diesem sind die Ohren, die beim Asiatischen Elefanten deutlich kleiner und auf dem oberen Rand gefaltet sind. Sie werden bis zu 60 cm hoch sowie 55 cm breit und bedecken eine Fläche von rund 0,5 m² (bezogen auf beide Ohrseiten). Die Dicke liegt bei nur rund 1,5 cm.[3] Stoßzähne werden in der Regel nur bei Bullen ausgebildet. Die Haut zeigt zumeist eine graue Tönung, Tiere im östlichen Teil des Verbreitungsgebietes haben häufig eine hellere Grundfärbung als solche aus dem westlichen. Teilweise treten einzelne pigmentfreie Zonen am Rüssel und an den Ohren auf, die dann fleischfarben erscheinen. Die Dicke der Haut variiert beträgt im Durchschnitt 18 mm, sie kann am Rücken jedoch bis zu 30 mm erreichen. Haare sind nur spärlich ausgebildet, aber dichter als beim Afrikanischen Elefanten. Häufig finden sich einzelne Büschel länglicher Haare, so an den Lippen, an den Beinen und am Schwanzende. Die Vorder- und Hinterfüße verfügen über jeweils fünf Zehen. Äußerlich sichtbar kommen an den Vorderfüßen fünf und an den Hinterfüßen vier bis fünf hufartige Nägel vor.[4][5]
Schädel- und Gebissmerkmale

Der Schädel des Asiatischen Elefanten ist massiv gebaut. Seine Länge beträgt bei Tieren aus Indien und Sri Lanka 86 bis 97 cm, bei solchen vom südostasiatischen Festland und von Borneo ist er mit 75 bis 80 cm durchschnittlich kürzer.[6][7] Generell ist der Schädel beim Asiatischen Elefanten nicht so aufgebläht wie bei seinen afrikanischen Verwandten, sondern stärker vorn und hinten gepresst und im Hinterhauptsbereich gestreckt. Dadurch wirkt er insgesamt höher. In Ansicht von vorn zeichnet sich die Stirnlinie durch zwei seitliche Buckel und eine konkave Eindellung dazwischen aus. Die Buckel können in Seitenansicht auch leicht über die Stirn hängen, so dass ein insgesamt eingedelltes Profil entsteht. Das Stirnbein ist schmaler sowie aufgewölbt und nicht breit und flach wie bei seinen afrikanischen Vettern. Die Alveolen der oberen Stoßzähne, die weitgehend durch den Mittelkieferknochen gebildet werden, stehen enger beisammen und sind nach unten gerichtet. Das weicht vom Afrikanischen Elefanten mit seinen seitlich ausscherenden Alveolen ab. Im Gegensatz zu diesem liegt die Nasenöffnung, also die Ansatzstelle für den Rüssel, beim Asiatischen Elefanten deutlich über der Orbita und nicht auf deren Ebene. Das hier ansetzende kurze Nasenbein ist schmaler und stärker nach vorn gerichtet. Die größte Breite des Schädels wird auf Höhe der Augenfenster erreicht, beim Afrikanischen Elefanten befindet sie sich deutlich niedriger. Am Hinterhauptsbein setzen die Gelenkflächen für die Wirbelsäulenverbindung markant höher an und sind deutlich gerundet. Die anschließende Schädelrückseite steigt dann steil auf, während sie beim Afrikanischen Elefanten zu einem gewissen Grad nach vorn geneigt ist. In Relation zur Lage der Hinterhauptsgelenke sitzt die Öffnung des Gehörgangs niedriger als beim Afrikanischen Elefanten. Weitere Unterschiede finden sich in der Gestaltung des Jochbogens, der Scheitelbeine oder am Kontakt von Mittelkieferknochen und Oberkiefer. Ein allgemeines Merkmal der Elefantenschädel ist die starke Ausbildung von luftgefüllten Kammern im Stirnbereich. Die bienenwabenartigen Strukturen durchsetzen weite Bereiche des Stirn-, Scheitel- und Nasenbeins sowie des Oberkiefers. Dadurch kommt es zu einer Volumenvergrößerung des Schädels, die diesen insgesamt leichter macht, zusätzlich aber auch eine größere Ansatzfläche für die massive Kau- und Nackenmuskulatur bereitstellt.[4][8][5]
Der Unterkiefer besteht aus massivem Knochen. Er ist beim Asiatischen Elefanten kurz sowie gestaucht gebaut und wirkt insgesamt geschwollen beziehungsweise nicht so langgestreckt wie beim Afrikanischen Elefanten. Seine Gesamtlänge entspricht in etwa der Gesamthöhe des aufsteigenden Astes. In Aufsicht zeigt er einen gerundeten bis U-förmigen Verlauf. Im Gegensatz dazu ist der Unterkiefer des Afrikanischen Elefanten V-förmig. Die Symphyse am vorderen Ende zur Verbindung der beiden Unterkieferhälften verläuft beim Asiatischen Elefanten stärker nach unten gerichtet, außerdem ist sie schmaler und verhältnismäßig kürzer als bei den afrikanischen Formen. Am aufsteigenden Ast richten sich der Kronen- und der Gelenkfortsatz deutlich nach innen, während sie beim Afrikanischen Elefanten gerade aufsteigen. Durch die Stauchung des Unterkiefers nimmt der Kronenfortsatz eine Position etwa in der Mitte der Unterkieferlänge ein. Die Gelenkfläche zur Verbindung mit dem Schädel ist seitlich gestreckt und nicht gerundet, zusätzlich auch nach vorn gerichtet. Auf der Außenseite des aufsteigenden Astes gräbt sich die Fossa masseterica beim Asiatischen Elefanten tiefer ein als beim Afrikanischen Elefanten und ist zusätzlich weiter ausgedehnt.[4][8][5]
Das Gebiss ist wie bei allen Elefanten hochgradig spezialisiert. Es besteht aus insgesamt 26 Zähnen mit folgender Zahnformel: . Im vorderen Gebiss sind somit nur die oberen Stoßzähne ausgebildet, die die hypertrophierten zweiten Schneidezähne darstellen. In der Regel besitzen beim Asiatischen Elefanten nur die Bullen Stoßzähne, Kühe haben aber manchmal kleine, hauerartige Zähne ohne Zahnpulpa (sogenannte tushes), die nur rund 20 cm lang werden und einen ovalen bis rundlichen Querschnitt aufweisen. Beim Afrikanischen Elefanten tragen dagegen häufig beide Geschlechter Stoßzähne. Die Ausbildung der Stoßzähne ist recht unterschiedlich bei den männlichen Tieren, da relativ häufig auch Individuen ohne derartige Bildungen auftreten. So haben beispielsweise nach Untersuchungen in Sri Lanka nur 2 bis 7 % der Elefantenbullen sichtbare Stoßzähne. Das Phänomen wird von manchen Autoren als artifiziell, durch die Jagd des Menschen verursacht, angesehen und ist auch vom Afrikanischen Elefanten belegt.[9][10][11][12] Der längste bekannte Stoßzahn eines Asiatischen Elefanten maß 326 cm, das schwerste Exemplar wog 73 kg.[13] Zahnschmelz ist zumeist nur an der Spitze ausgebildet. Die Stoßzähne verlaufen beim Asiatischen Elefanten stärker nach unten und weniger seitlich orientiert als beim afrikanischen Vetter. Auch sind sie bei ersterem deutlich gerade und krümmen sich erst im weiteren Verlauf.[4][8][5]

Das hintere Gebiss besteht aus drei Prämolaren und drei Molaren je Kieferhälfte. Erstere sind als Bildungen des Milchgebisses aufzufassen, letztere stellen die permanenten Zähne dar. Der Zahnwechsel erfolgt wie beim Afrikanischen Elefanten horizontal und nicht vertikal wie bei den meisten anderen Säugetieren üblich. Dabei schiebt sich von hinten kontinuierlich ein neuer Zahn heraus, während der vordere durch Beanspruchung abgekaut wird und schließlich herausfällt. Prinzipiell befinden sich dadurch bei den Elefanten lediglich ein bis anderthalb Zähne je Kieferhälfte in Funktion. Im Laufe seines Lebens tauscht der Asiatische Elefant infolge dieses horizontalen Zahnwechsels fünfmal seine Zähne aus. Die genaue Abfolge ist weniger gut untersucht als beim Afrikanischen Elefanten. Die erste Generation an Zähnen (dP2) durchbricht den Kieferknochen bereits vor der Geburt. Sie fällt etwa im Alter von 2 Jahren aus. Die nachfolgenden Zähne dP3 und dp4 sind mit etwa 5 bis 6 beziehungsweise mit rund 13 Jahren weitgehend abgekaut. Der erste dauerhafte Molar (M1) fällt mit rund 25 Jahren aus, während der zweite (M2) vermutlich in der Mitte der 30er-Phase oder etwas später verloren geht. Von da an verbleibt nur der jeweils letzte Molar (M3) im Maul.[14][4] Wie bei allen Elefanten bestehen die Backenzähne aus einer Reihe von Schmelzfalten von lamellartiger Gestalt. Die einzelnen Schmelzfalten haben einen parallelen Verlauf und lassen die für die afrikanischen Elefanten typisch rautenförmige Aufwölbung in der Mitte vermissen. Durch höhere Abkauung der Zähne lösen sich die Schmelzfalten häufig in separate Schleifen auf. Im Vergleich zu den afrikanischen Formen ist der Asiatische Elefant bezüglich des Zahnbaus moderner gestaltet. Er weist höhere (hypsodonte) Zahnkronen und eine höhere Anzahl an Schmelzfalten auf, deren Anzahl vom ersten bis zum letzten Zahn hin ansteigt. Auf dem vordersten Prämolaren befinden sich durchschnittlich vier bis sechs Falten, auf dem letzten Molaren schwankt die Anzahl zwischen 20 und 29. Die unteren Zähne verfügen zumeist über mehr Schmelzfalten als die oberen. Die Lamellenfrequenz (Anzahl der Lamellen auf 10 cm Zahnlänge) beträgt damit 5 bis 9 und ist deutlich höher als beim Afrikanischen Elefanten. Die dichte Lage an Schmelzfalten bedingt, dass die jeweilige Zahnschmelzdicke mit 2,5 bis 3,0 mm relativ gering ist. Das Gewicht der einzelnen Zähne variiert beträchtlich. Der letzte Molar kann bis zu 5,2 kg wiegen, der vorderste Prämolar bringt dagegen nur rund 9,0 g auf die Waage.[15][4]
Verbreitung und Habitat
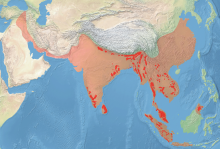
Das Verbreitungsgebiet wildlebender Asiatischer Elefanten umfasst heute das südliche und südöstliche sowie die südlichsten Bereiche des östlichen Asiens. Die Art ist in rund einem Dutzend Ländern heimisch. Das Vorkommen erstreckt sich von Indien, Nepal und Bhutan im Westen über Sri Lanka, Bangladesch, Myanmar, Thailand und Kambodscha bis nach Laos, Vietnam und China im Osten und Malaysia beziehungsweise Indonesien im Süden. Die Gesamtgröße der Verbreitung wird je nach Quelle mit rund 487.000[16] bis 879.000 km²[17] angegeben, kann aber durchaus auch kleiner sein.[18] Ursprünglich war der Asiatische Elefant von Westasien bis nach Ostasien verbreitet und besiedelte eine Fläche von circa 9 Millionen Quadratkilometern. Die westliche Population, die bis nach Syrien vordrang, starb aber vermutlich bereits im 8. bis 9. Jahrhundert v. Chr. aus. Die östliche erlosch wohl während der Song- und Ming-Dynastie zwischen dem 12. und 17. Jahrhundert.[18][19][16]
In Indien kam der Asiatische Elefant einst in weiten Teilen des Subkontinents vor. Heute beschränkt sich sein Auftreten im Wesentlichen auf vier Regionen:[20][21][22][23][24][16]
- Im Nordwesten leben zerstreute Bestände in den Vorbergen des Himalaya von Uttaranchal und Uttar Pradesh, von denen einige Herden auch nach Nepal wandern;
- Im Nordosten reicht die Verbreitung von der östlichen Grenze Nepals im Norden Westbengalens über Assam entlang der Vorberge des Himalaya bis ins östliche Arunachal Pradesh und Nagaland; weiter im Westen bis in die gebirgigen Regionen von Meghalaya und bis in die Ebenen des Brahmaputra;
- In zentralen Teil des Landes sind äußerst fragmentierte Populationen auf dem Chota-Nagpur-Plateau in Orissa und Jharkhand dokumentiert, zusätzlich seit Mitte der 1980er Jahre auch im südlichen Landesteil von Westbengalen und Andhra Pradesh;
- Im Süden leben einzelne Populationen verstreut in den Tälern der West- und Ostghats in Karnataka, Kerala, Tamil Nadu und Andhra Pradesh;
Indien beherbergt die größte wilde Population des Asiatischen Elefanten innerhalb der Grenzen eines Landes mit schätzungsweise 26.000 bis 28.000 Tieren. Rund die Hälfte davon lebt im südlichen Teil des Landes, ein weiteres Drittel im Nordosten. Der Rest verteilt sich auf die beiden anderen Regionen, eine sehr kleine Gruppe von rund 40 Tieren ist auf den Andamanen heimisch.[24]
In den angrenzenden Ländern in Bangladesch und Bhutan ist der Asiatische Elefant zumeist im Grenzgebiet zu Indien anzutreffen, in der Regel nutzen die Tiere hier für Menschen wenig attraktive Gebiete. Die nepalesischen Bestände sind ebenfalls weitgehend grenznah im Tiefland zu finden. Die einst weit über Sri Lanka verteilten Tiere kommen dort nur noch im trockeneren Osten in den tieferen Landesteilen vor. Auch im südöstlichen Asien bestehen in der Regel zerstreute Populationen, wobei die Art in Laos noch recht weit verbreitet ist, während sie in Kambodscha und Vietnam überwiegend die südlichen Bereiche besiedelt. Größere Bestände in Thailand und Myanmar sind im Grenzgebiet der beiden Länder beobachtet worden, in ersterem auch auf der Malaiischen Halbinsel, wo noch größere Waldgebiete vorkommen. Von hier aus tritt der Asiatische Elefant dann im Landesinneren von Malaysia auf. Auf dem Malaiischen Archipel findet er sich nur noch auf Borneo und Sumatra, den beiden größten Sundainseln. Die Bestände sind aber stark zersplittert. In China beschränkt sich die Art auf die südlichsten Bereiche der Provinz Yunnan, etwa den autonomen Bezirk Xishuangbanna und die nördlich angrenzende kreisfreie Stadt Pu’er.[25][26] Im Gegensatz zu Indien liegen zu den einzelnen Populationen nur wenige Untersuchungen vor.[21][24][16]
Der Asiatische Elefant ist ein Generalist, der verschiedene Landschaftsräume von offenen Grasländern über immergrüne tropische Regenwälder, laubwechselnde Wälder sowie Sekundärwälder bis hin zu Buschland und kultivierten Gebieten nutzt. Seine heutige Verbreitung ist weitgehend ein Resultat der dichten menschlichen Besiedlung im Verbreitungsgebiet. In Regionen mit einer geringen menschlichen Besiedlungsdichte nutzt der Asiatische Elefant vor allem Übergangszonen von geschlossenen Wäldern hin zu offenen Graslandschaften oder grasdominierte Habitate. So bevorzugt er etwa in Sri Lanka savannenartige Gebiete vor Wäldern. Die Höhenverbreitung reicht vom Meeresspiegelniveau bis auf rund 3000 m Höhe, in größeren Höhenlagen sind die Tiere etwa im östlichen Teil des Himalaya vor allem im Sommer anzutreffen. Über die Bestandsdichte liegen nur wenige Informationen vor. Für den Bardia-Nationalpark in Nepal wurde sie auf 0,5 Individuen je Quadratkilometer in der Trockenzeit bestimmt.[27] Eine vergleichbar große Fläche im Biligiri Rangaswamy Temple Tiger Reserve im südlichen Indien trägt dem gegenüber 1,7 Individuen.[28] Untersuchungen in den Jahren 2005 bis 2009 im Udawalawe-Nationalpark in Sri Lanka erbrachten eine über diesen Zeitraum intakte Population des asiatischen Elefanten bestehend aus 800 bis 1160 Individuen. Sie setzte sich aus rund 240 Bullen sowie knapp 290 Kühen zusammen, der Rest verteilte sich auf Kälber und Jungtiere. Das Verhältnis von männlichen zu weiblichen Tieren betrug demnach 0,84:1, im Schnitt kamen etwa 102 bis 116 Kühe auf rund 100 km² vor.[11][16][5]
Lebensweise
Territorialverhalten
Allgemein und Aktivitäten
Im Gegensatz zum Afrikanischen Elefanten ist die Lebensweise des Asiatischen Elefanten in vielen Aspekten weniger gut erforscht. Die Tiere sind dämmerungs- und tagaktiv. Die prinzipiellen Tagesaktivitäten finden nach Untersuchungen von Tieren in Sri Lanka in den Morgenstunden zwischen 08:00 und 10:00 Uhr sowie am späten Nachmittag zwischen 16:00 und 18:00 Uhr statt. Geringe Unterschiede bestehen zwischen männlichen Tieren und den Familiengruppen mit früherem Aktivitätsbeginn bei ersteren. Verschiebungen sind vor allem in Regionen mit stärkerer menschlicher Beeinflussung zu beobachten. Während der Tageshitze ruhen die Tiere zumeist.[29] Bestimmte Aktivitäten finden auch nachts statt, deren Intensität geht aber gegenüber denen bei Tageslicht deutlich zurück.[30] Die Hauptaktivität des Asiatischen Elefanten besteht in der Nahrungsaufnahme, die den größten Teil des verfügbaren Zeitbudgets in Anspruch nimmt. Andere häufige Tätigkeiten sind Laufen oder Auskundschaften unbekannter Objekte sowie Stehen. Daneben kommen noch eine Reihe weiterer Aktivitäten vor, die aber eine eher untergeordnete Rolle einnehmen, etwa Spielen, mit dem Schwanz oder den Ohren wedeln, Bäder in Wasser, Schlamm oder Staub und Ähnliches.[29][31][32][33] Etwa alle anderthalb Stunden defäziert der Asiatische Elefant, was eine Frequenz von 18- bis 20-mal am Tag ergibt.[29] Die tägliche Schlafdauer ist relativ gering und liegt bei circa 4,6 Stunden mit leichten Unterschieden zwischen den Jahreszeiten. Die meisten Ruhephasen beginnen kurz nach Mitternacht. Zumeist schläft ein Tier stehend. Eine liegende Position wird nur selten eingenommen, in dieser verbringt ein Tier dann rund eine Stunde.[34][35] Ausnahmen bilden Kälber, die durchschnittlich länger schlafen und ruhen als ausgewachsene Tiere und zumeist dabei liegen. Eine stehende Position ist etwa ab dem neunten Lebensjahr üblich.[36]
Die Körpertemperatur des Asiatischen Elefanten beträgt rund 36 °C. Sie variiert über den Tag zwischen 35,7 und 36,8 °C. Die Änderungen verlaufen parallel zum Tagesrhythmus mit der niedrigsten Körpertemperatur in der späten Nacht und der höchsten am späten Tag. Da der Asiatische Elefant nicht schwitzen oder hecheln kann, sind seine Möglichkeiten der Wärmeabgabe begrenzt. Die Absenkung der Körpertemperatur während der kühleren Nacht schafft damit möglicherweise einen Temperaturpuffer für den nächsten Tag. Prinzipiell ähnelt dieses Verhalten einigen heterothermen wüstenbewohnenden Huftieren.[37] Eine weitere Möglichkeit zur Regulierung der Körpertemperatur findet sich in der Verdunstung von Wasser an der Körperoberfläche.[38] Eine Funktion der wedelnden Ohren hierbei – wie häufig angenommen – besteht aber wahrscheinlich nicht.[39]
Sozialstruktur und Raumnutzung


Der Asiatische Elefant weist eine komplexe Sozialstruktur auf, generell besteht keine Territorialität. Die engste Verbindung erwächst zwischen dem Mutter- und dem Jungtier. Mehrere dieser Verbindungen formen eine Familiengruppe oder Herde. Die Größe einer Herde nimmt mit der Anzahl der gebärfähigen Generationen zu. Nach Untersuchungen in Sri Lanka setzen sich solche Familiengruppen aus 2 bis 28 Individuen zusammen, mehr als die Hälfte der Gruppen ist aber kleiner und umfasst 6 oder weniger Tiere.[29][40] Zwei beobachtete Herden in den Westghats im südlichen Indien bestanden aus 8 beziehungsweise 19 Individuen. Die größere der beiden schloss 11 ausgewachsene weibliche Individuen und jeweils 4 Kälber sowie Jungtiere ein, die kleinere vereinte 4 Kühe sowie jeweils 2 Kälber und Jungtiere, hinzu kam noch ein einzelner Bulle.[31] Die Individuen aus einem Familienverband sind miteinander verwandt, was durch die gleichen Haplotypen angezeigt wird. Genetische Untersuchungen indizieren nur wenig Austausch mütterlicherseits zwischen den einzelnen Herden.[41][42] Generell wird angenommen, dass der Familienverband beim Asiatischen Elefanten lockerer strukturiert ist als beim Afrikanischen Elefanten. Eventuell ähnelt er mehr dem des Waldelefanten (Loxodonta cyclotis), dessen waldreiches Habitat durch das günstigere Nahrungsangebot auch stärker mit dem des Asiatischen Elefanten übereinstimmt als im Vergleich zu den jahreszeitlich beeinflussten Savannenlandschaften, die der Afrikanische Elefant bewohnt. Bestätigt wird dies durch Langzeituntersuchungen im Udawalawe-Nationalpark in Sri Lanka. Hier ergab sich, dass überwiegend Gruppengrößen mit 3 Individuen auftreten, die einem lockeren Familienverband aus rund einem Dutzend oder mehr Tieren angehören. Die jeweilige Zusammensetzung der kleinen Gruppe variiert und kann sich innerhalb eines Tages ändern, sie ist somit nicht an äußere Faktoren gekoppelt. Bei den Studien zeigten sich außerdem bestimmte individuelle Bevorzugungen bei den Gruppenbildungen, wodurch jede Kuh mit mehr oder weniger fest definierten anderen Individuen eine temporäre Gemeinschaft bildet. Die einzelnen Gruppen mögen so nur kurzfristig bestehen, sie formieren sich aber über bestimmte Zeitintervalle beständig neu und können daher als langfristig stabil angesehen werden. Jedes Individuum ist als Folge dieser beständigen Gruppenneubildung innerhalb der genetisch verwandten Familiengruppe stark sozial vernetzt. Das Formieren und Auseinanderbrechen der kleinen Gruppen ähnelt dem „Fission-Fusion“-Sozialgefüge („Trennen und Zusammengehen“) des Afrikanischen Elefanten. Im Gegensatz zu diesem, bei dem sich häufig im jahreszeitlichen Rhythmus ganze Familiengruppen zu Clans zusammenschließen, findet dies beim Asiatischen Elefanten auf einer niedrigeren Ebene statt. Als unmittelbare Folge daraus ist die soziale Hierarchie beim Asiatischen Elefanten eher flach und eine Matriarchin wie beim Afrikanischen Elefanten, also die älteste und erfahrenste Kuh, die die jeweilige Herde anführt, spielt eine deutlich geringere Rolle. Die für die Herden des Afrikanischen Elefanten typische lineare Rangfolge, bei der nach dem Tod der Leitkuh eine der ältesten Töchter die Führung übernimmt, ist beim Asiatischen Elefanten aus diesen Gründen ebenfalls schwächer ausgeprägt. Mitunter bilden sich auch beim Asiatischen Elefanten größere Herdenverbände, dies geschieht aber weitaus seltener.[43][44][45]

Das Sozialgefüge der Bullen ist wesentlich weniger gut untersucht. In der Regel leben sie allein oder, wenn sie noch relativ jung sind, in eigenen Verbänden. Diese Verbände sind jedoch weitgehend instabil und eine innere Hierarchie ist unbekannt. Zur Paarung schließen sie sich einer Herde an und können mehrere Monate in der Gesellschaft der Kühe verbringen. Da die Paarung nicht jahreszeitlich gebunden ist, findet man zu jeder Zeit in etwa 40 % der Herden wenigstens einen Bullen. Die Bullen sind untereinander nur selten aggressiv, so dass es gelegentlich mehr als einen Bullen in einer Herde gibt. Ausnahmen bilden allerdings Phasen, in denen Kühe in die Brunft kommen.[46][29]
Die einzelnen Familiengruppen und Bullen nutzen je nach Region unterschiedlich große Aktionsräume. Die jeweilige Ausdehnung richtet sich nach der Verfügbarkeit der Nahrungsressourcen und des Wassers sowie dem Habitat. In stärker von Menschen besiedelten Gebieten spielt die Fragmentierung und Beeinflussung der Landschaftsräume eine große Rolle. Zumeist schließen die Aktionsräume unterschiedliche Landschaftstypen ein, die im jährlichen Zyklus genutzt werden. Die dabei unternommenen Wanderungen beschränken sich in den meisten Fällen auf den jeweiligen Aktionsraum, so dass der Asiatische Elefant mitunter recht standorttreu ist. Das führt auch dazu, dass einzelne Tiere oder Familiengruppen beispielsweise bessere Nahrungsquellen außerhalb ihres jeweiligen Territoriums nicht erschließen.[47] In mehreren Untersuchungen in fragmentierten Waldgebieten in den Westghats des südlichen Indiens umfassten die jeweiligen Aktionsräume verschiedener Herden zwischen 105 und 350 km² mit einer erheblichen räumlichen Überlappung. Saisonal variierte die jeweilige Größe des Aktionsraums bedeutend, auch nutzten die Herden unterschiedliche Kernzonen von rund 35 bis 50 km² Größe. In der Regel hielten sich die Tiere tagsüber überwiegend in natürlichen Regen- oder in Auwaldgebieten auf, nachts bevorzugten sie Landschaften in Fluss- oder Wassernähe, mieden aber Sümpfe und vor allem menschliche Ansiedlungen. Nur gelegentlich verrichteten die Familiengruppen ihre Aktivitäten auf den angrenzenden Plantagen. In einem übergeordneten jährlichen Rhythmus sammelten sich die Tiere zur Trockenzeit in Kurzgraslandschaften in Flusstälern auf einem engeren Raum, streuten dann aber in der Regenzeit auf ausgedehntere Flächen und drangen in Landschaften mit längeren Gräsern vor.[48][49] Im zentralen Indien ließen sich für die Aktionsräume des Asiatischen Elefanten variierende Größen ermitteln, sie beliefen sich auf 259 bis 4349 km². Die stark differierenden Größen ergaben sich daraus, dass einige Individuen erheblich ausgedehntere jährliche Wanderungen unternahmen, die vor allem in der Regenzeit und teilweise linear über Entfernungen von bis zu 250 km stattfanden, während andere in ihrer angestammten Region verblieben. Die jahreszeitlich tatsächlich in Anspruch genommenen Flächen waren in allen Fällen aber deutlich kleiner und engten sich auf 35 bis 55 km² ein.[50] Tiere im südöstlichen Sri Lanka bewegen sich hingegen innerhalb von 41 bis 459 km² großen Aktionsräumen, die eigentlichen Kerngebiete machen rund ein Viertel dieser Fläche aus. Auch hier kommt es zu deutlichen Überschneidungen der Areale. Im Gegensatz zu den Populationen des indischen Subkontinents ließen sich bisher aber keine größeren jährlichen Migrationen feststellen.[51] Wenige Informationen liegen zu den Populationen Südostasiens vor. Eine Untersuchung aus den 1970er Jahren bestimmte die Größe der Aktionsräume auf der malaiischen Halbinsel auf 59 bis 167 km².[52] Eine mit einem Radiosender ausgestattete Kuh bewegte sich in den 1990er Jahren im Taman Negara in Malaysia über eine Fläche von rund 6800 km². Da das Tier frisch umgesiedelt worden war, erwiesen sich seine Wanderungen als eher orientierend denn als ein tatsächliches Aktionsgebiet nutzend. Später schränkten sich die Bewegungen auf Gebiete von 350 beziehungsweise 9 km² ein. Dem gegenüber war das Aktionsgebiet eines gleichzeitig beobachteten Bullen im selben Schutzgebiet rund 340 km² groß.[53] Wiederum ein junger Bulle aus Kelantan, ebenfalls Malaysia, hatte im Jahr 2011 innerhalb von vier Monaten ein Gebiet von rund 9,5 km² erschlossen, wobei das jeweils tatsächlich genutzte Areal kleiner war. Die zurückgelegte Strecke belief sich auf 88 km.[54] Für Tiere auf Borneo wurde eine Ausdehnung der Aktionsräume von 250 bis 400 km² in ungestörten Wäldern und von rund 600 km² in fragmentierten Landschaften bestimmt. Die Kerngebiete waren deutlich kleiner. Im Durchschnitt legten die Herden je Tag rund 1,1 bis 1,8 km zurück, eine Gruppe überwand in rund vier Monaten etwa 200 km. Bei menschlicher Störung konnte die täglich bewältigte Entfernung auf bis zu 9,5 km ansteigen. Ein Großteil der Elefanten auf Borneo nutzt Wälder in rund 300 m Meeresspiegelhöhe.[52]
Agonistisches Verhalten und Kommunikation


Das Aufeinandertreffen von zwei Individuen kann auf unterschiedlichste Art verlaufen. Nimmt ein Individuum ein anderes wahr, so hebt es in der Regel den Rüssel mit der Rüsselspitze in Richtung des Gegenübers und dreht den Körper. Je nach Situation werden auch die Ohren aufgestellt, der Kopf bleibt in normaler Stellung oder ist leicht erhoben. Kontaktaufnahmen erfolgen durch Betasten mit dem Rüssel, häufig im Gesichtsbereich an den Ohren, Augen, Maul und Temporaldrüsen, aber auch am Schwanz, im Geschlechtsbereich oder an den Füßen, mitunter schließt der Kontakt auch das Einführen des Rüssels in das Maul des anderen Tiers ein. Die folgende weitere Intensität ist häufig abhängig davon, inwiefern sich einzelne Individuen kennen oder einander fremd sind. Dies führt im ersteren Fall bei gleichgeschlechtlichen Tieren zu einem marginalen bis toleranten Verhalten. Im letzteren kann es zu spielerischen Kämpfen oder „Pseudokämpfen“ kommen, die in der Regel bei jüngeren Bullen vorherrschen. Hierbei wird bei direkter Konfrontation mit Distanzen von 5 bis 10 m der Kopf leicht angehoben, die Ohren gespreizt und der Rüssel hin- und hergeschwungen. Der darauffolgende Angriff endet meist in einem Schiebe- und Drückwettkampf mit umeinandergeschlungenen Rüsseln. Kann keiner der Kontrahenten die Oberhand gewinnen, wiederholt sich der Prozess mitunter mehrfach. Bei fortpflanzungsbereiten Bullen sind die Kämpfe dagegen aggressiver Natur. Initiale Kontakte zwischen Individuen unterschiedlichen Geschlechts, etwa bei Begegnungen eines Bullen mit einer Familiengruppe, sind ähnlich strukturiert. Im Folgenden ignorieren die älteren Kühe häufig den Bullen, in seltenen Fällen versuchen sie ihn zu vertreiben.[29][55]
Die Kommunikation des Asiatischen Elefanten findet auf verschiedenen Ebenen statt und besteht aus taktilen, visuellen, olfaktorischen und akustischen Signalen. Vor allem in der taktilen Kommunikation nimmt der Rüssel eine zentrale Stellung ein, da er nicht nur Informationen weitergibt, sondern diese auch von anderen Individuen empfängt.[56] Das umfangreiche Repertoire an chemischer Kommunikation schließt etwa die Unterscheidung von sexuell aktiven oder inaktiven Individuen ein. Dies erfolgt sowohl zwischen männlichen und weiblichen Tieren als auch unter den Geschlechtsgenossen. Wichtige Signalträger sind hier Pheromone. So lösen beispielsweise bestimmte Pheromone weiblicher Tiere in der Vorbrunst ein Flehmenartiges Gebaren bei männlichen Individuen aus. Der Wirkstoff hierfür ist Looplure ((Z)7-Dodecenylacetat, chemische Formel C14H26O2), der auch bei einigen Insekten wie Schmetterlingen als Sexualpheromon vorkommt.[57][58][59] Ein weiteres Pheromon bei Bullen, Frontalin (1,5-Dimethyl-6,8-dioxa-bicyclo[3.2.1]octan, chemische Formel C8H14O2) genannt, wird über die Temporaldrüse ausgesendet und führt bei brünftigen Kühen zu einem starken Paarungsverhalten, erzeugt bei sonstigen weiblichen Individuen oder anderen männlichen dagegen nur geringe Reaktionen. Die Aufnahme der Geruchsspur erfolgt olfaktorisch oder taktil mit der Spitze des Rüssels, deren „Finger“ mit zahlreichen Vibrissen unterschiedlichster Funktion und Mechanorezeptoren ausgestattet ist.[60][61][62][63][64][65] Chemische Signale dienen aber nicht nur dem Erkennen von Artgenossen, der Asiatische Elefant vermag auch bei artfremden Lebewesen – wie beispielsweise den Menschen – zwischen bekannten und fremden Individuen zu unterscheiden.[66] Experimente zeigen darüber hinaus, dass die Tiere auf bestimmte Geruchsspuren trainiert werden und dieses Wissen über mehrere Monate behalten können.[67][68] Beim Aufstampfen mit den Füßen entstehen seismische Wellen, die sich im Untergrund fortbewegen und noch in 32 km Entfernung messbare Ausschläge erzeugen. Einige Forscher sind der Ansicht, dass die sehr großen Gehörknöchelchen des Asiatischen Elefanten diesen befähigt, auch seismische Signale zu empfangen, was wiederum der Kommunikation über große Entfernungen zugute käme.[69]
Weitaus weniger gut untersucht ist die Lautsprache des Asiatischen Elefanten. Bisher sind etwas mehr als ein Dutzend Vokalisierungen registriert worden. Diese lassen sich in insgesamt vier Grundtöne unterteilen, die aus einem Trompeten, Tschirpen/Quieken, Brüllen und Grollen bestehen. Jeder dieser Grundtöne kann verschiedene Nuancen beinhalten. Trompeten und Brüllen stellen häufig einen Ausdruck der Störung, Aggression, aber auch des Spiels dar, während Tschirpen/Quieken Verwirrung oder Uneinigkeit wiedergibt. Alle drei Lauttypen finden im hohen Frequenzbereich zwischen 300 und 6150 Hz statt. Am vielfältigsten sind die verschiedenen Groll-Laute, die in einem niedrigen Frequenzbereich von 10 bis 173 Hz ertönen und überwiegend bei sozialen Kontakten eingesetzt werden, entweder innerhalb einer Herde oder zwischen verschiedenen Herden. Sie dienen darüber hinaus zum Versammeln der einzelnen Gruppenmitglieder, die unter Umständen weiter verstreut sind und aus Distanzen von über 100 m herankommen. Dies geschieht auch, wenn der Rufer durch Vegetation verdeckt ist. Das Grollen verleitet Individuen in der Regel zu einer Antwort, so dass eine Art Chor entsteht, in dem einzelne Stimmen nur schwer unterscheidbar sind. Es kann in Entfernungen von bis zu rund 500 m wahrgenommen werden. Mit Hilfe der Groll-Laute im Infraschall-Bereich kann eine Gruppe über große Distanzen koordiniert werden. Einhergehen die Lautgebungen mit einem leicht erhobenen Kopf, schlackernden Ohren und einem geöffneten Maul. Die Töne werden von nahezu allen Gruppenmitgliedern ausgestoßen, Ausnahmen bilden Junge unter zwei Jahren. Gelegentlich treten auch Kombinationen aus Grollen und Tschirpen oder Brüllen auf, deren Funktion nicht ganz eindeutig ist.[70] Innerhalb einer Familiengruppe ist das soziale Grollen die weitaus häufigste Kommunikationsform und erreicht über 60 % aller ausgestoßenen Rufe. Von Bullen wird das soziale Grollen dagegen weitaus seltener eingesetzt. Ähnlich wie der Afrikanische Elefant benutzt der Asiatische Elefant zwei unterschiedliche Arten von Grolllauten, die einerseits nasal, andererseits oral erzeugt werden. Beide Grollvarianten werden wohl in unterschiedlichen Situationen eingesetzt.[71] Männliche Tiere in der Musth haben eigene Lautgebungen in einer Kombination aus Grollen und Tschirpen, die mit 60 bis 250 Hz ebenfalls sehr niederfrequent ertönen und mitunter mehrere Stunden anhalten.[72][73][74][29][4] Jungtiere verfügen im Vergleich zu ausgewachsenen Individuen über ein ähnliches Lautrepertoire, das aber strukturell abweicht. Es wird überwiegend beim Spiel eingesetzt, wobei hier Trompeten und Tschirpen überwiegt. Brülllaute ertönen meist mit aufmerksamkeitsbindender Funktion, etwa bei der Trennung vom Muttertier.[75] Übereinstimmend mit seinem afrikanischen Verwandten kann auch der Asiatische Elefant fremde Laute imitieren, was innerhalb der Säugetiere eine eher seltene Befähigung ist. Der Nutzen dieser liegt wohl in der Stärkung der Bindung innerhalb der Familiengruppe und dem Erkennen beziehungsweise Unterscheiden gruppenzugehöriger oder gruppenfremder Individuen.[76][77]
Komfortverhalten und kognitive Fähigkeiten

Zum Komfortverhalten zählen unter anderem ausgiebige Bäder an Wasserstellen. Hierbei spritzt sich der Asiatische Elefant mit Wasser ab, das er vorher in den Rüssel gesaugt hat. Vergleichbar dazu sind auch Staub- und Schlammbäder, bei denen sich die Tiere im Bodensubstrat wälzen oder ebenfalls mit dem Rüssel bespritzen. Zumeist kann dies nach dem Baden beobachtet werden, in vielen Fällen findet es synchronisiert in einer Familiengruppe statt, so dass dem gemeinsamen Bad eine soziale Funktion zugeschrieben werden kann. Ob damit auch eine direkte Thermoregulation des Körpers verbunden ist, lässt sich nicht eindeutig aussagen. Ein Hinweis darauf ist, dass die Bäder vielfach während der wärmsten Tageszeit stattfinden, die einzelnen Individuen begehen diese jedoch in unterschiedlicher Intensität. Eventuell stehen die Wasser-, Staub- und Schlammbäder in einem direkten Zusammenhang mit der Hautpflege und dem Schutz vor Parasiten.[78] Damit verbunden ist das Reiben an Bäumen oder Felsen sowie mit dem Rüssel und dem Schwanz. Gelegentlich finden sich an Bäumen auch Schnittmarken, hervorgerufen durch die Stoßzähne. Auf Sri Lanka wurde dies häufig bei verschiedenen Pterocarpus- und Careya-Arten beobachtet, aus deren Einschnitten ein leicht riechender Pflanzensaft austrat.[29]

Die kognitiven Fähigkeiten des Asiatischen Elefanten sind schon länger Gegenstand von Untersuchungen. Bereits in den 1950er Jahren wurden Versuchsreihen gestartet, bei denen ein Elefant bis zu 20 Musterpaare erlernte und diese sowohl als Paar als auch einzeln identifizieren konnte. In einer weiteren Versuchsreihe war der Elefant befähigt, nach einem Jahr 13 zuvor erlernte Musterpaare wiederzuerkennen. Selbst nach über 30 Jahren erinnerte sich das Tier noch an den Test, war aber nicht mehr in der Lage, die Musterpaare korrekt zuzuordnen.[79] Andere Untersuchungen betrafen Unterscheidungstests in Form von „Schwarz/Weiß“ oder „Klein/Groß“. Hierbei lernten jüngere Tiere deutlich schneller als ausgewachsene.[80][81] Erwähnenswert sind auch das Zähl- und Additionsvermögen sowie das Vergleichen unterschiedlicher Summen untereinander.[82][83] Letzteres bewältigt der Asiatische Elefant nicht nur über visuelle Begutachtung, sondern auch mit dem Rüssel über den Geruchssinn.[84] Zusätzlich führen neben optischen Signalen auch olfaktorische zur Entscheidungsfindung, ob sich in bestimmten Situationen weiterführende Handlungen lohnen oder nicht.[85] Im Jahr 2006 wurde bekannt, dass der Asiatische Elefant zur Selbstwahrnehmung befähigt ist. Den Spiegeltest bestand allerdings nur eines von drei Individuen,[86][87] zuvor waren ähnliche Versuche gescheitert.[88] Die Ergebnisse sind aber konsistent zu anderen Tierarten wie etwa dem Schimpansen, bei denen rund die Hälfte der Tiere den Test erfolgreich absolvierte. Die Ich-Reflexion schließt auch die Wahrnehmung des eigenen Körpers mit ein, der mitunter zur Erfüllung einzelner Handlungen als Hindernis aufgefasst werden kann.[89] Teilweise setzen die Tiere ihren Rüssel gezielt als Druckluftpumpe ein, um für sie nicht erreichbare Gegenstände wie etwa Nahrung in greifbare Nähe zu bringen, wofür häufig nur einige wenige Luftstöße ausreichen. Die Manipulation der Umwelt durch Luft ist bisher einmalig unter den Säugetieren und setzt ein gewisses Verständnis für die physikalische Umwelt voraus.[90] Innerhalb der einzelnen Familiengruppen besteht darüber hinaus auch ein gewisses Einfühlungsvermögen in die Not oder Bedürfnisse anderer Individuen, die häufig durch äußere Einflüsse entstehen, beispielsweise durch Trennung von der Gruppe oder aggressives Verhalten eines Artgenossen. Beistand durch andere Individuen kann dabei auf verschiedene Weisen ausgedrückt werden, etwa körperlich durch Berührungen des bedrängten Tieres mit dem Rüssel ins Maul beziehungsweise an den Genitalbereich oder durch Lautgebungen wie Tschirpen oder Trompeten.[91] Generell ist die Kooperation in der Herde relativ groß, was unter anderem Unterstützung verletzter Mitglieder einschließt.[92] Auch können zwei oder mehrere Individuen zusammenarbeiten, um gemeinsam eine Aufgabe zu bewältigen.[93] Gelegentlich wird wie beim Afrikanischen Elefanten beobachtet, dass einzelne Tiere sich mit den Knochen verstorbener Individuen auseinandersetzen, in dem sie die Schädel mit dem Rüssel berühren oder beschnüffeln.[94]
Ernährung

Die Ernährung des Asiatischen Elefanten basiert sowohl auf harter als auch weicher Pflanzennahrung. Dadurch besteht die Hauptnahrung aus Gräsern, Blättern, Samen, Früchten und Zweigen. Er kann daher als generalisierter Pflanzenfresser angesehen werden (mixed feeder). Die genaue Zusammensetzung der Nahrung ist regional und jahreszeitlich abhängig von der jeweiligen Verfügbarkeit von Pflanzen. Häufig sinkt der Anteil an weichen Pflanzenbestandteilen wie Blättern oder Früchten in der Regenzeit zu Gunsten von härteren Pflanzen wie Gräsern, die dann frisch wachsen. In der Regel ist das Artenspektrum der konsumierten weicheren Pflanzen vielfältiger als das der härteren.[5] Untersuchungen zur Ernährung liegen aus den verschiedenen Teilen des Verbreitungsgebietes vor. In mehreren Studien wurde das Nahrungsspektrum im südlichen Indien auf insgesamt 112 beziehungsweise 84 Pflanzenarten bestimmt,[95][96] im südnepalesischen Chitwan-Nationalpark sowie im angrenzenden Parsa-Wildreservat liegt die Anzahl bei 57 Nahrungspflanzen,[97] während im nordöstlichen Indien 20 beziehungsweise 36 Pflanzenarten vorherrschen.[98][99] Die Tiere im südlichen China vertilgen dem gegenüber bis zu 83 verschiedene Pflanzenarten,[100] im nordwestlichen Sri Lanka sind es 116 Nahrungspflanzen.[101] Zu den besonders häufig verzehrten harten Pflanzen gehören hauptsächlich Süßgräser. Je nach Region können Silberhaargras, Zitronengräser, Bambus und Vertreter der Gattung Leersia vorherrschen. Bei den überregional am meisten konsumierten Gräsern sind jene der Gattungen Themeda und Saccharum zu nennen. Unter den äußerst vielfältigen weicheren Nahrungspflanzen haben Akazien, Feigen, Bananen, der Kamalabaum, der Salbaum sowie Balsambaum- und Lorbeergewächse, aber auch Sternbüsche und zusätzlich Zizyphus sowie Albizia eine gewisse Bedeutung. Neben den jahreszeitlich bedingten Variationen bestehen weitere Unterschiede zwischen den verschiedenen bewohnten Landschaftstypen, wie die Analysen im südlichen Indien hervorhoben. In offenen Graslandschaften dominieren Gräser das Nahrungsspektrum, in waldreicheren Habitaten hingegen weiche Pflanzenteile. In gemischten Landschaften zeigt sich das Verhältnis zwischen harten und weichen Pflanzen eher ausgeglichen. Über das Jahr gesehen überwiegt die Grasnahrung aber deutlich über der weichen Pflanzenkost.[95][96] Auch im südlichen Nepal weisen die Tiere der verschiedenen Standorte teils unterschiedliche Präferenzen auf. Das resultiert beispielsweise in einer artenreicheren Nahrung im Parsa-Wildreservat gegenüber dem unmittelbar angrenzenden Chitwan-Nationalpark.[97] Auffällig ist zusätzlich, dass nach den Nahrungsanalysen im südlichen China früh wachsende Pflanzen häufiger verzehrt werden als spät wachsende. Hier ließ sich des Weiteren als bemerkenswerter Effekt eine negative Korrelation zwischen der Diversität der aufgenommenen Pflanzen und den steigenden Temperaturen sowie Niederschlägen über das Jahr feststellen.[100] Unter den Nahrungspflanzen kann auch ein gewisser Anteil an kultivierten Arten ausgemacht werden, der mitunter ein Viertel der dokumentierten Pflanzen einnimmt. Betroffen darunter sind unter anderem Bananen, Kokosnuss, Mangos und Fingerhirse. In vielen Fällen bezieht der Asiatische Elefant diese von zurückgelassenen Ernteerträgen.[95][101] Über die Ernährungsgewohnheiten der Tiere in den Gebieten Südostasiens mit dichtem Bewuchs an tropischen Regenwäldern ist weitaus weniger bekannt, einzelne Studien liegen etwa von der Malaiischen Halbinsel und von Sumatra vor. Generell ähnelt die Nahrungszusammensetzung jener in den nördlicheren Gebieten. Allerdings tendiert der Asiatische Elefant hier zu einer nicht so stark grasbasierten Ernährung in der Regenzeit. Erklärt wird diese mit den weniger vorhandenen offenen Grasflächen und dem höheren Nährstoffgehalt der weichen Pflanzenkost in der Region.[102][103]

Die Nahrung wird überwiegend mit dem Rüssel aufgenommen, häufig kommt nur das Ende des Rüssels zum Einsatz, das sich um die Pflanze schlingt und diese herauszieht. Die Flexibilität des Rüssels erlaubt den Tieren nicht nur eine große Menge an Nahrung zu verzehren, sondern diese auch selektiv auszusuchen. Die Selektivität zeigt sich unter anderem bei den Gräsern, da der Asiatische Elefant je nach Fortschritt des Pflanzenwachstums unterschiedliche Abschnitte abgrast. Anfänglich vertilgen die Tiere nur die oberen Partien der Gräser, erst ab einer Wuchshöhe von rund 0,5 m reißen sie die gesamte Pflanze aus dem Boden, verschmähen aber die Wurzelabschnitte. Letztere konsumiert der Asiatische Elefant in der fortgeschrittenen Regenzeit nach gründlicher Säuberung von der anhaftenden Erde, was durch mehrfaches Schütteln des Rüssels geschieht. Sehr kurze Grasstände lockert der Asiatische Elefant vorher durch Tritte mit den Vorderfüßen. Teilweise werden mit den Füßen auch Zweige und Äste festgehalten, um kleinere Teile zu entfernen. Der Einsatz der Füße stellt einen wichtigen Verhaltensunterschied zum Afrikanischen Elefanten dar, bei dem überwiegend die Stoßzähne für solche Arbeiten zum Einsatz kommen.[29][95] Das Entrinden von Bäumen, das ebenfalls vom Afrikanischen Elefanten bekannt ist, kann regional häufig vor allem in der Trockenzeit beobachtet werden. Im nordostindischen Bundesstaat Tripura tätigt der Asiatische Elefant dies überwiegend an Teak- und Cashewbäumen, in Südindien sind unter anderem Sternbüsche sowie Kydia- und Careya-Arten häufig betroffen. Hier konnten auch Unterschiede im Landschaftstyp bemerkt werden, da das Entrinden wesentlich intensiver in trockenen laubwerfenden Wäldern als in feuchten Wäldern oder in Buschlandschaften ausfiel. Das Entrinden endet unter Umständen im vollständigen Umknicken der Bäume.[104][99]
Pro Tag nimmt ein Asiatischer Elefant etwa 150 kg an Nahrung zu sich. Dafür investiert er 17 bis 19 Stunden eines 24-h-Tages oder 60 bis 91 % seines verfügbaren Aktivitätsbudgets. Je Stunde konsumiert ein Tier damit zwischen 5,5 und 10,5 kg Nahrung. Eine mit dem Rüssel aufgenommene Nahrungsmenge umfasst etwa 150 g. Schätzungsweise führt ein Tier alle zwei Minuten den Rüssel zum Maul, in selteneren Fällen, etwa beim Verzehr von Früchten, bis zu dreimal je Minute.[29][105][96][102] Die intensivsten Fressphasen finden während der frühen Morgen- und späten Abendstunden zwischen 06:00 und 09:00 beziehungsweise 15:00 und 17:00 Uhr statt. In den Mittagsstunden mit der größten Tageshitze gehen die Aktivitäten stark zurück. Die morgendlichen und abendlichen Fressphasen sind stärker in der Trockenzeit ausgebildet als in der Regenzeit. Auch zeigen sich Variationen je nach Landschaftstyp, da in feuchteren Regionen keine so eindeutige bimodale Teilung in der Nahrungsaufnahme feststellbar ist als in trockeneren Habitaten.[96] Außerdem sucht der Asiatische Elefant wenigstens einmal täglich eine Wasserstelle auf. Ebenso wie bei der Nahrungsaufnahme findet der Rüssel auch beim Trinken Einsatz, in dem er mit Wasser vollgesogen und anschließend zum Maul geführt wird. Lediglich Jungtiere wurden beobachtet, wie sie Wasser direkt mit dem Maul aufschlürften. Zumeist sucht der Asiatische Elefant die gleichen Wasserstellen auf. Während ausgedehnter Trockenphasen und versiegender Oberflächenwässer gräbt er mit den Füßen im sandigen Boden nach Grundwasser. Des Weiteren haben Salz- und Minerallecken eine große Bedeutung, die von den Tieren regelmäßig begangen werden.[106][107] Ausnahmen bilden wohl Populationen, die in Regionen mit hohem Salz- und Mineralgehalt im Boden leben, etwa in Küstennähe.[4][5]
Fortpflanzung
Brunft und Paarung

Im Allgemeinen kann sich der Asiatische Elefant ganzjährig verpaaren. In Regionen mit einer stärkeren jahreszeitlichen Gliederung ist die Fortpflanzung aber deutlicher saisonal gebunden, was unter anderem die Überlebensrate der Neugeborenen erhöht.[5][108] Der Sexualzyklus der Kühe ist mit 14 bis 16 Wochen ausgesprochen lang (eine ursprünglich angenommene Dauer des Sexualzyklus von 18 bis 27 Tagen[109] beruht auf der beobachten sexuellen Empfangsbereitschaft der Kühe). Er teilt sich in eine 8 bis 12 Wochen lange luteale und eine 4 bis 8 Wochen lange follikuläre Phase. Getrennt sind beide durch eine nonluteale Phase, während der es zu einer erhöhten Produktion von luteinisierenden Hormonen mit einem zweigipfligen Ausstoß in einem Abstand von drei Wochen kommt. Lediglich die zweite Phase führt auch zur Ovulation, die Funktion der ersten Phase ist bisher ungeklärt. Durch den langen Sexualzyklus sind Kühe in der Regel nur drei- bis viermal jährlich empfangsbereit.[110][111][112] Äußerliche Anzeichen der Brunft sind bei weiblichen Tieren kaum feststellbar. Mitunter verlässt ein Tier die Familiengruppe oder es kommt zu verstärkten Schwanzbewegungen beziehungsweise Rüsselkontakten der Herdenmitglieder überwiegend an den Geschlechtsorganen. Wahrscheinlich ist auch ein erhöhter Schleimfluss aus dem Urogenitalbereich ein Hinweis für den Beginn des Sexualzyklus.[46][112]
Bei Bullen drückt sich die Paarungsbereitschaft durch die Musth aus. Erkenntlich ist sie an der generell höheren Aggressivität und an einem dunkel gefärbten Sekret, das an den Temporaldrüsen austritt. Zum Höhepunkt der Musth läuft dieses Sekret über das Gesicht der männlichen Tiere an den Mundwinkeln vorbei. Weitere Anzeichen finden sich in der Rastlosigkeit der Tiere, in einem häufigen Urinieren sowie in einer verminderten Nahrungsaufnahme. Generell ist die Musth mit einer Erhöhung des Testosteron-Spiegels verbunden. Dabei steigt der Testosterongehalt des Blutes von 0,2 bis 1,4 ng/ml in der Vor-Musth-Phase auf 30 bis über 65 ng/ml in der vollen Musth-Phase an. Gleichzeitig kommt es zu einem relativen Abfall des Gehalts an Androstendion.[113] Die Musth tritt bei Bullen jährlich auf, sie ist aber unter den einzelnen Individuen abweichend von der Brunft männlicher Huftiere nicht synchronisiert. Dadurch sind männliche Tiere in der Musth über das gesamte Jahr verteilt präsent. Mitunter finden sich häufiger Musth-Tiere in den feuchteren als vergleichsweise in den trockeneren Jahreszeiten. Erste Anzeichen für die Musth bilden sich sporadisch schon bei männlichen Tieren ab dem 14. Lebensjahr heraus. Die vollständige Ausprägung erfolgt aber erst mit dem 20. bis 25. Lebensjahr. Die Dauer variiert zwischen einigen Wochen und bis zu fünf Monaten.[114][115] Die hohe Aggressivität der Bullen während der Musth richtet sich zumeist gegen Geschlechtsgenossen und ermöglicht es ihnen, andere männliche Tiere außerhalb dieser Phase zu dominieren. Kämpfe sind prinzipiell rar, können aber vehement durchgeführt werden. Sie bestehen dann aus Rammstößen mit dem Kopf, Fechten mit den Stoßzähnen und Ringkämpfen mit dem Rüssel. Unter Umständen resultieren sie in abgebrochenen Stoßzähnen oder aber im Tod des gegnerischen Individuums, häufig endet aber der Kampf mit der Flucht des unterlegenen Tiers. Begleitet werden die Kämpfe von Trompetenrufen.[55][92][46][116][4][5]
Bullen in der Musth begeben sich auf Wanderung auf der Suche nach paarungsbereiten Kühen und schließen sich so in deren Verlauf verschiedenen Herden an, was zu einer erheblichen Erweiterung des Aktionsraumes führt. Nach Beobachtungen im Nagarahole- und Bandipur-Nationalpark im südlichen Indien verbringen Jungbullen in der Musth jedoch durchschnittlich weniger Zeit mit weiblichen Tieren und verweilen in kleineren Herden als Altbullen in der Musth, die sich zumeist länger und in größeren Familiengruppen aufhalten. Prinzipiell können sich Bullen auch außerhalb der Musth verpaaren, ihre Möglichkeiten sind aber durch die potentielle Anwesenheit von Musth-Tieren eingeschränkt. In Junggesellengruppen erreicht meistens nur der kräftigste und älteste Bulle die Musth, so dass auch der soziale Rang einen gewissen Einfluss hat.[46] Dies deckt sich mit Beobachtungen im Nagarahole- und Bandipur-Nationalpark, bei denen ältere Musth-Bullen jüngere Nicht-Musth-Bullen in Gegenwart einer Kuh tolerieren. Umgekehrt tritt aber so gut wie nie ein junger Bulle in der Musth in der Nähe eines älteren Bullen in der Musth mit weiblicher Begleitung in Erscheinung. Dadurch lässt sich aussagen, dass die Musth den Bullen zwar Vorteile bei der Paarung mit Kühen bringt, diese aber zumeist erst mit höherem Individualalter der männlichen Tiere wirksam werden.[117]

Die Begegnungen zwischen paarungsbereiten männlichen und weiblichen Tieren hat eine Reihe unterschiedlicher Handlungsabläufe zur Folge. In der Regel dienen sie in erster Linie zur Bestimmung von Geschlecht und Empfangsbereitschaft, wofür zumeist der Rüssel eingesetzt wird. Besonders intensiv untersuchte Körperabschnitte befinden sich am After und in der Geschlechtsregion, an den Füßen und im Gesichtsbereich, bei Bullen dann überwiegend die Temporaldrüsen. Höchstwahrscheinlich erfolgt die Identifikation über Geruchsspuren etwa aus dem Urin. Die gesamte Partnerwahl innerhalb einer Herde kann drei bis vier Wochen Zeit in Anspruch nehmen. Weibliche Tiere wählen häufig größere Bullen in der Musth als Partner gegenüber jüngeren Tieren ohne Musth-Anzeichen. Das Tragen von Stoßzähnen scheint ebenfalls eine Rolle zu spielen. Ausgebildete Stoßzähne führen aber nicht gleichzeitig zum Paarungserfolg, da im Dominanzkampf der Bullen die Musth und die Körpergröße eine bedeutendere Rolle spielen.[118][119] Eine ablehnende Haltung seitens der umworbenen Kuh drückt diese über Lautgebungen aus.[92] Zum unmittelbaren Paarungsspiel gehören Ringkämpfe mit dem Rüssel, Nackenbisse und Besteigungsversuche. Sie werden teilweise unterbrochen, während die Tiere Äste oder Bäume brechen, ihre Körper mit Schlamm oder Staub besprühen sowie sporadisch Nahrung aufnehmen. Während der Kopulation verhält sich die Kuh passiv. Das Aufsitzen des Bullen dauert häufig nicht länger als 30 Sekunden, währenddessen er mehrfach bis zu 8 Sekunden lang seinen Penis in die Vagina einführt. Dies erfolgt mehrfach binnen weniger Minuten.[46][92][4]
Geburt und Individualentwicklung


Die Tragzeit dauert im Durchschnitt 640 Tage (rund 22 Monate). Nach Beobachtungen bei 18 tragenden Kühen im Pinnawela Elephant Orphanage in Sri Lanka fand die Geburt durchschnittlich 667 Tage nach der Befruchtung statt. In der Regel wird ein einzelnes Kalb zur Welt gebracht, das bei der Geburt zwischen 80 und 110 kg wiegt und eine Schulterhöhe von 75 bis 90 cm hat.[4] Unterschiede zwischen männlichen und weiblichen Kälbern sind nicht bekannt, im Pinnawela Elephant Orphanage betrug das Geburtsgewicht für beide Geschlechter rund 83 kg, die Schulterhöhe variierte zwischen 87 und 88 cm.[120] Neugeborene haben ein braunes und für Elefanten relativ dichtes Haarkleid. Sie können bereits innerhalb einer Stunde nach der Geburt stehen und laufen, nach gut drei Stunden saugen sie erstmals Milch.[121] Ein Junges bekommt dabei nicht unbedingt nur von der Mutter, sondern auch von anderen Kühen der Herde Milch. Zum Saugen wird das Maul und nicht der Rüssel verwendet.[4] In der Zeit nach der Geburt kümmert sich die gesamte Herde intensiv um das Kalb und integriert es in die Familiengruppe. Die Distanz des Kalbes zu den anderen Gruppenmitgliedern ist sehr gering und beträgt häufig nur rund 5 m. Etwa die Hälfte der Zeit verbringt das Kalb ruhend, häufig während der dunklen Tageszeit, ein weiteres Viertel mit der Nahrungsaufnahme.[36] Nach sechs Monaten beginnt es eigenständig Gras und Blätter zu fressen, saugt aber gelegentlich noch bis ins zweite Lebensjahr. Die Wachstumsrate in den ersten sechs Jahren ist relativ hoch und in beiden Geschlechtern identisch. Ab diesem Zeitpunkt entwickeln sich beide Geschlechter unterschiedlich. Bei weiblichen Tieren verlangsamt sich das Wachstum etwa ab dem 10. Lebensjahr, bei männlichen kommt es erst ab etwa dem 15. Jahr zu einer erheblich geringeren Größenzunahme.[29][122] Im Alter von rund vier Jahren beginnen junge männliche Tiere eigene Ausflüge außerhalb der mütterlichen Herde zu unternehmen. Sie verbringen zunehmend weniger Zeit mit der Familiengruppe und formen ab dem siebenten bis achten Jahr temporäre Verbände im Randbereich der Gruppe oder gesellen sich mit älteren Bullen zusammen. Die weiblichen Nachkommen bleiben dagegen ein Leben lang in ihrer Herde.[4][5]
Das Geburtsintervall liegt bei 4,8 bis 7,9 Jahren, was durchschnittlich länger ist als beim Afrikanischen Elefanten. Aufgrund des langen Intervalls haben Kühe eine Geburtsrate von weniger als 0,2 Kälber je Jahr. Bei Muttertieren mit männlichen Kälbern währt dies durchschnittlich länger als bei solchen mit weiblichen. Das Geschlechtsverhältnis bei der Geburt liegt bei 1:1, bei der zweiten Geburt einer Kuh kommen aber mitunter mehr männliche Kälber zur Welt.[123][120] Die Überlebensrate der Kälber ist für gewöhnlich hoch. Einen großen Einfluss haben äußere Umweltbedingungen, da die optimale Überlebenstemperatur für Kälber bei etwa 24 °C liegt. Bei signifikant tieferen Temperaturen ist die generelle Konstitution der Jungtiere ausschlaggebend für das Überleben, höhere Temperaturen führen dagegen zu einem stärkeren Erkrankungsrisiko. Ebenso sind feuchtere Jahreszeiten mit einer stärkeren Überlebensrate verbunden als im Vergleich zu trockeneren.[124] Männliche und weibliche Tiere treten mit 14 bis 16 Jahren in die sexuelle Unabhängigkeit ein. Jungkühe bringen nach Untersuchungen im Udawalawe-Nationalpark mit durchschnittlich 13,4 Jahren ihr erstes Kalb zur Welt, im Pinnawela Elephant Orphanage erfolgt die erste Geburt im Alter von rund 14,6 Jahren.[123][120] Anekdotische Berichte liegen aber auch von weitaus jüngeren trächtigen Tieren vor (acht bis neun Jahre). Gleiches gilt für Jungbullen, bei denen sich das erste Sperma bereits mit sieben oder acht Jahren bilden kann. Junge männliche Tiere haben aber meist weder die körperliche Voraussetzung noch eine sozial dominante Stellung für eine Verpaarung mit Kühen.[125] Weibliche Tiere sind bis in ein hohes Alter von rund 60 Jahren reproduktionsfähig.[123] Die Lebensdauer in freier Wildbahn beträgt, limitiert durch die letzten Zähne, etwa fünfzig bis sechzig Jahre. Haltung in menschlicher Obhut verkürzt häufig die Lebensspanne des Asiatischen Elefanten. Berichte von Tieren mit Alterswerten von über 80 Jahren sind unbestätigt. Hierbei handelte es sich in der Vergangenheit zumeist um Wildfänge, deren Alter beim Fang unbekannt war und geschätzt wurde.[126][4][5]
Fressfeinde, Parasiten und Ökologie
Fressfeinde und Interaktionen mit anderen Tierarten

Der Asiatische Elefant hat keine natürlichen Feinde. Gelegentlich erbeutet der Tiger ein Jungtier.[127] Im Bedrohungsfall werden Jungtiere von ausgewachsenen Gruppenmitgliedern eingekreist.[91] Gelegentlich fallen die Raubtiere aber auch ausgewachsene Individuen an, wie Untersuchungen an Kadavern im Corbett Tiger Reserve im nördlichen Indien zeigen. Da hier die Jagdbeute in der Trockenzeit drastisch zurückgeht, handelt es sich wohl um eine Reaktion des Tigers auf extreme äußere Bedingungen.[128] Dabei scheint der Asiatische Elefant den Tiger durchaus als Beutegreifer wahrzunehmen. Nahegelegt wird dies durch Experimente mit nächtlichen Brüllrufen der Raubkatze, die zum leisen Rückzug der Elefanten führten. Auf das Gebrüll eines Leoparden reagierte der Asiatische Elefant zwar auch mit Rückzug, verband dies aber mit lautem Grollen und Trompeten.[129]
Mehrere andere große Säugetiere treten im Verbreitungsgebiet des Asiatischen Elefanten auf. Herauszuheben ist unter anderem das Panzernashorn. Direkte Begegnungen zwischen Asiatischem Elefanten und Panzernashorn können zur Verteidigungshandlung des Panzernashorns führen. Elefantenkühe weichen häufig aus, -bullen reagieren ihrerseits ebenfalls mit Angriff.[130] In Bezug auf die Ernährungsweise zeigten sich nach Untersuchungen im nepalesischen Bardia-Nationalpark kaum Konkurrenz zwischen den beiden Arten. Die Nahrung des Asiatischen Elefanten bestand hier zur Trockenzeit zu 65 % aus weicher und zu 24 % aus harter Pflanzenkost. Die Nahrungspräferenz des Panzernashorns verhielt sich umgekehrt zu der des Asiatischen Elefanten, da bei ihm harte Gräser vor weichen Pflanzenteilen dominierten. Überschneidungen betrafen etwas mehr als ein Drittel der Nahrungspflanzen, größte Gemeinsamkeiten ließen sich in der Bevorzugung von Saccharum als Hauptgrasnahrung aufzeigen.[27]
Parasiten
Unter den äußeren Parasiten sind unter anderem Gnitzen der Gattung Culicoides belegt, die normalerweise die Ohrregion befallen und sowohl als Überträger von Filariosen als auch der Leucocytozoonose fungieren. Weitere Ectoparasiten treten mit Fliegen wie etwa Stomoxys, Chrysomya, Haematobia sowie Tabanus und mit Tierläusen wie Linognathus in Erscheinung. Innere Parasiten werden durch Spulwürmer der Gattung Toxocara, verschiedene Fadenwürmer wie Murshidia, Strongyloides, Enterobius, Quilonia, Amira oder Bathmostomum, Saugwürmer wie beispielsweise Fasciola oder Bandwürmer, so Anoplocephala vertreten.[131][132][133][134] Variationen haben jahreszeitliche Ursachen mit einem hohen Befall während der Trockenzeit und einem geringeren in der Regenzeit.[131] Für gewöhnlich sind Kühe häufiger betroffen als Bullen.[133][134] Ein bemerkenswerter Effekt unter den Bullen besteht darin, dass Individuen mit stärker entwickelten Stoßzähnen zumeist seltener von inneren Parasiten heimgesucht werden.[135] Gelegentlich infizieren sich einzelne Individuen mit der Maul- und Klauenseuche als Folge eines direkten oder indirekten Kontakts mit Haustieren.[136]
Ökologische Bedeutung
Als ein wichtiges Agens kann der Einfluss des Asiatischen Elefanten auf die jeweilige Landschaft mitunter dramatisch sein. Er besteht im Öffnen und Lichten von Wäldern, zudem auch in einer gewissen Umstrukturierung der Zusammensetzung eines Biotops. Ein einzelnes Tier benötigt bis zu 150 kg an Pflanzennahrung täglich. Auf das Jahr gerechnet entspricht dies je nach Größe des Individuums 27,5 bis 55 t oder je nach Effizienz der genutzten Nahrung 10,5 t je Quadratkilometer. Weiterer Einfluss entsteht durch das Abbrechen von Ästen oder Umknicken von Bäumen mit nicht unmittelbarem Bezug zur Nahrungsaufnahme. Lokal kann dies die natürliche Vegetation stark beeinflussen und unter Umständen zum lokalen Aussterben einzelner bevorzugter, aber wenig verbreiteter Nahrungspflanzen führen, wie etwa bei Grewia- und Desmodium-Arten im Bardia-Nationalpark. Auf der anderen Seite regt dies auch zum intensiveren Wachstum anderer Nahrungspflanzen an, beispielsweise bei Vertretern der Gattung Mallotus oder von Macaranga, welche die von den Elefanten geschaffenen Lücken im Wald ausnutzen. Prinzipiell sind die Wechselwirkungen zwischen langlebigen Lebewesen wie Elefanten und Bäumen bisher nur unzureichend erforscht.[137][138][29]

Wie seinem afrikanischen Vetter kommt dem Asiatischen Elefanten eine bedeutende Rolle als Verbreiter von Samen zu. Die mit den Früchten aufgenommenen Samen passieren den Magen-Darm-Trakt in durchschnittlich 35 bis 39, im Maximum in 114 Stunden. Verbunden mit den täglichen Wanderungen des Asiatischen Elefanten führt dies dazu, dass die Samen im Mittel rund 1,2 km weit transportiert werden, bevor sie durch die Dungausscheidungen wieder auf den Erdboden gelangen. In Einzelfällen ließen sich auch Entfernungen von 5,7 km nachweisen. Unter anderem profitieren davon besonders Akazien, der Tamarindenbaum oder Rosenapfelbäume, deren Früchte vergleichsweise häufig vom Asiatischen Elefanten gefressen werden. Insgesamt ist er je nach Region an der Verbreitung von 29 bis über 60 Pflanzenarten beteiligt.[139][140][141][142]
Auch in anderen Bereichen erfüllt die Art eine wichtige ökologische Funktion, Untersuchungen sind hier aber im Vergleich zum Afrikanischen Elefanten bisher rar. Entsprechend der aufgenommenen Nahrung hinterlässt ein Asiatischer Elefant bis zu 180 kg Kot täglich. Der ausgeschiedene Dung wird als Rückzugsgebiet verschiedener Lebewesen genutzt, darunter neben zahlreichen Insekten wie Käfern beispielsweise von Fröschen.[143] Letztere laichen auch in wassergefüllten Trittsiegeln, die mitunter über ein Jahr bestehen bleiben können und so als temporäre Stillwasserbereiche fungieren.[144] An den in sandigen Flussbetten gescharrten Wasserlöchern bedienen sich wiederum andere Tiere wie Mungos zur Versorgung mit Süßwasser. Ebenso wechseln auf den Elefantenpfaden – die durch beständige Nutzung teils vegetationsfrei sowie bis zu 7 cm in den Untergrund eingetieft sind und sich dadurch markant hervorheben – auch weitere größere Säugetiere, genannt werden können hier verschiedene Büffel oder Sambars.[29]
Systematik
Innere Systematik der heutigen Elefanten nach Meyer et al. 2017[145]
|
Der Asiatische Elefant ist eine Art aus der Gattung Elephas und darin der einzige rezente Vertreter. Elephas bildet die Schwestergruppe zur Gattung der Afrikanischen Elefanten (Loxodonta), in der der Afrikanische Elefant (Loxodonta africana) und der Waldelefant (Loxodonta cyclotis) stehen. Die beiden Gattungen wiederum stellen die gegenwärtigen Angehörigen der Familie der Elefanten (Elephantidae) innerhalb der Ordnung der Rüsseltiere (Proboscidea) dar. Als eine sehr alte Gruppe originär afrikanischer Tiere reichen die Ursprünge der Rüsseltiere rund 60 Millionen Jahre in die Vergangenheit zurück. Sie erwiesen sich im Verlauf ihrer Stammesgeschichte als sehr vielfältig und waren an zahlreiche Biotope und Klimaregionen angepasst. Vertreter der Rüsseltiere besiedelten so weite Teile Eurasiens und Amerikas. Im Vergleich zur langen Stammesgeschichte der Rüsseltiere sind die Elefanten als relativ junge Entwicklungslinie aufzufassen. Ihre frühesten Formen lassen sich im ausgehenden Miozän nachweisen. Vorläufer der heutigen Formen traten fossil vor rund 7 Millionen Jahren in Erscheinung.[146] Übereinstimmend dazu trennten sich die beiden heutigen Gattungen laut molekulargenetischen Analysen vor gut 7,6 Millionen Jahren voneinander ab. Aus genetischer Sicht sind aber nicht die Afrikanischen Elefanten die nächsten Verwandten von Elephas, sondern die ausgestorbenen Mammute (Mammuthus), deren Abspaltung sich vor 6,7 Millionen Jahren vollzogen hat.[147][148][149] Beide zusammen bilden die Tribus der Elephantini, die Afrikanischen Elefanten dagegen die Loxodontini.[150][151]
Innere Systematik des Asiatischen Elefanten nach Girdland et al. 2018[152] (basierend auf genetischen Daten)
|
In der Regel werden drei Unterarten des Asiatischen Elefanten anerkannt:[4][5]
- E. m. indicusCuvier, 1798 (Indischer Elefant); asiatisches Festland;
- E. m. maximusLinnaeus, 1758 (Sri-Lanka-Elefant); Sri-Lanka;
- E. m. sumatranusTemminck, 1847 (Sumatra-Elefant), Sumatra und Borneo;
Als Unterscheidungsmerkmal zwischen den Festlandsformen und den auf Sumatra beheimateten Tieren wird häufig die Anzahl der Rippen angegeben, die bei ersteren 20, bei letzteren 19 beträgt.[4][151] Generell bedarf die innere Systematik des Asiatischen Elefanten einer Revision. Nach genetischen Analysen lassen sich innerhalb der Art zwei Kladen („α-Klade“ und „β-Klade“) unterscheiden, die sich wohl schon im Altpleistozän vor etwa 1,80 bis 1,95 Millionen Jahren herausgebildet und nachfolgend vor etwa 1,6 („β-Klade“) und vor etwa 0,9 Millionen Jahren („α-Klade“) weiter differenziert haben. Damit könnten zwei eigenständige taxonomische Einheiten des Asiatischen Elefanten bestehen. Beide Kladen sind jeweils über das nahezu gesamte festländische Verbreitungsgebiet verteilt, die „β-Klade“ hat zusätzlich noch die Malaiische Inselwelt erschlossen. Die Tiere der Malaiischen Halbinsel und von Sumatra formen innerhalb der „β-Klade“ eine abgetrennte Untergruppe („β2-Klade“), deren Ursprung bis ebenfalls vor rund 0,9 Millionen Jahren zurückreicht. Die Daten unterstützen allerdings nicht die Integrität der Population von Sri Lanka, da sich Individuen der Insel in beiden Kladen wiederfinden. In bestimmten Bereichen des Verbreitungsgebietes kommt es zu Hybridbildungen zwischen beiden Kladen.[153][154][155][156][157][158]
Teilweise werden noch drei weitere Unterarten aufgeführt, von denen zwei allerdings in jüngerer Zeit ausgestorben sind:[16][159]
- † E. m. asurusDeraniyagala, 1950 („Syrischer Elefant“); Westasien;
- E. m. borneensisDeraniyagala, 1950 („Borneo-Zwergelefant“); Borneo;
- † E. m. rubridensDeraniyagala, 1950; Ostasien;
Für alle drei Formen ist die systematische Eigenständigkeit problematisch, häufig gelten sie als synonym zu E. m. indicus oder E. m. maximus.[4] Die Beschreibung von E. m. asurus beruht weitgehend auf einem Molar aus dem Sumpfgebiet des al-Habbaniyya-Sees westlich von Bagdad sowie auf antiken Darstellungen.[159] Die vermutete Synonymität der ausgestorbenen Form mit den heutigen Vertretern findet Unterstützung durch genetische Daten an rund 5500 Jahre alten westasiatischen Individuen, die einer der beiden rezenten Kladen („β-Klade“) des Asiatischen Elefanten entsprechen. Die Tiere lassen sich somit in die Variationsbreite der heutigen Populationen einbinden. Die nächste verwandte Gruppe findet sich in Südostasien.[152] Einige Wissenschaftler halten das ehemalige Vorkommen des Asiatischen Elefanten in Westasien nicht für endemisch, sondern von den Menschen der Vorgeschichte verursacht. Demnach wäre die Verbreitung der Tiere dort ein Resultat des Rohstoffbedarfs und der -nutzung seitens der bronzezeitlichen Kulturen, die jüngere Individuen aus den weiter östlich gelegenen Verbreitungsgebieten einführten. Untermauert wird diese Ansicht durch den bisherigen Befund an fehlenden Hinweisen einer kontinuierlichen Besiedlung Westasiens durch den Asiatischen Elefanten vom ausgehenden Pleistozän bis in das entwickelte Holozän. Das Verschwinden der Tiere aus der Region zu Beginn des ersten Jahrtausends v. Chr. lässt sich nach Meinung der Forscher einerseits auf Mensch-Tier-Konflikte verursacht durch den hohen Nahrungsbedarf der Elefanten zurückführen, andererseits dürften die eher unwirtlichen, wüstenartigen Bedingungen in Westasien auch keine größere Population an Elefanten getragen haben.[160]
Eine ähnliche Diskussion betrifft die Tiere von Borneo, deren heutige Population sich auf den Nordosten der Insel beschränkt. Ihre Herkunft ist unbekannt, subfossile Reste von Elefanten auf Borneo sind nicht belegt. Häufig wird eine Einführung als domestizierte Tiere durch den Menschen im 17. oder 18. Jahrhundert angenommen. Einige Forscher sehen den „Borneo-Zwergelefanten“ als Nachfahren der einst auf Java verbreiteten, im Verlauf des 14. Jahrhunderts dort ausgerotteten Elefanten an.[7] In Bezug auf die Körpermaße unterscheiden sich die Tiere von Borneo nicht von anderen Vertretern des Asiatischen Elefanten aus der Region, sie sind aber durchschnittlich etwas kleiner als die Angehörigen der Festlandspopulationen. Dem gegenüber können genetische Untersuchungen die Elefanten von Borneo gut von den anderen Elefanten Asiens absetzen. Sie stehen innerhalb der „β-Klade“, eine nähere genetische Verwandtschaft mit den Tieren von Sumatra und Malaysia besteht allerdings nicht. Die Trennung von den anderen Linien der „β-Klade“ setzte möglicherweise bereits im Mittelpleistozän vor rund 300.000 Jahren ein.[161] Daher vermuten andere Forscher wiederum einen endemischen Ursprung der Borneo-Population. Sie durchlebte dann in der Vergangenheit einen starken Einbruch und erholte sich erst in jüngerer Zeit wieder.[162]
Darüber hinaus werden der Gattung Elephas neben dem Asiatischen Elefanten noch weitere ausgestorbene Arten zugewiesen:[15]
- Elephas hysudricusFalconer & Cautley, 1845
- Elephas hysudrindicusDubois, 1908
- Elephas planifronsFalconer & Cautley, 1845
- Elephas platycephalusOsborn, 1929
Stammesgeschichte
Die Gattung Elephas taucht vergleichsweise spät im Fossilbericht auf. Zahlreiche afrikanische Funde, die ursprünglich mit Elephas in Verbindung gebracht wurden (so „Elephas“ ekorensis, „Elephas“ recki oder „Elephas“ iolensis), stehen in der Entwicklungslinie der Gattung Palaeoloxodon, die wiederum nähere Beziehungen zu den Afrikanischen Elefanten aufweist. Dazu gehören aber auch verschiedene Nachweise aus Eurasien, sowohl kontinentalen Ursprungs (beispielsweise „Elephas“ antiquus und „Elephas“ namadicus) als auch von mehreren Inseln des Mittelmeers (etwa einzelne Zwergelefanten wie „Elephas“ falconeri).[163][145]


Eindeutige frühe Belege der Gattung Elephas finden sich in den Siwaliks in Südasien, so unter anderem Zahnfunde aus der Nagrota- und Uttarbaini-Formation, deren Alter mit 3,6 bis 2,5 Millionen Jahren in den Übergang vom Pliozän zum Pleistozän datiert. Allgemein werden die frühen Formen zu Elephas planifrons gestellt, einem kleinen Vertreter der Gattung. Seine Zähne wiesen noch vergleichsweise niedrige Zahnkronen und mit 8 bis 12 Schmelzfalten eine relativ geringe Anzahl auf den jeweils letzten Mahlzahn auf. Der Zahnschmelz war dick, die Lamellenfrequenz variierte zwischen 2,5 und 5,5. Weitere besondere Merkmale finden sich am Schädel mit einem breiten und flachen Gesichtsbereich sowie einer tiefen Einsenkung auf der Stirn. Die Hinterhauptsgelenke saßen relativ hoch, zudem waren die Alveolen der oberen Stoßzähne stärker nach vorn als nach unten orientiert.[164][15] Im Verlauf des Unteren Pleistozäns wird Elephas planifrons dann weitgehend durch Elephas hysudricus ersetzt, das recht häufig in Erscheinung tritt. Die Form ist nicht nur in Südasien belegt, wo neben Resten aus den Siwaliks auch solche aus dem Flusstal des Narmada im zentralen Indien überliefert sind,[165][166] sondern war auch in verschiedenen Fundstellen Westasiens präsent, etwa in der Levante.[167] Teilweise kommt es hier zum sympatrischen Auftreten mit Vertretern von Palaeoloxdon wie etwa Palaeoloxodon antiquus (Europäischer Waldelefant) oder Palaeoloxodon namadicus. Elephas hysudricus zeichnet sich durch eine höhere Lamellenfrequenz von 3,9 bis 6,5 aus, was eine größere Anzahl an Zahnschmelzfalten von 12 bis 17 auf den letzten Mahlzähnen zur Folge hat. Die Zähne sind allgemein schon eher hochkronig, da sie ihre Breite um bis zu 60 % übertreffen. Im Schädelbau gleicht die Art dem heutigen Asiatischen Elefanten, häufig wird sie als deren direkter phylogenetischer Vorläufer betrachtet.[15] Sowohl Elephas planifrons als auch Elephas hysudricus waren im Jahr 1845 durch Hugh Falconer und Proby Thomas Cautley wissenschaftlich eingeführt worden.[168] Als jeweiliges Typusmaterial gelten einzelne Schädelfunde aus den Siwaliks, deren Festlegung erst 1886 durch Richard Lydekker erfolgte.[169] Die Art Elephas platycephalus ist von nur einem einzigen Fund, einem Teilschädel mit stark abgekauten hinteren Backenzähnen, aus der Nähe von Shimla in Nordindien überliefert. Der Schädel zeichnet sich durch einen weitgehend flachen sowie langgestreckten Bau aus und wirkt dadurch primitiv. Sein genaues Alter und seine exakte phylogenetische Stellung sind unklar. Eingeführt wurde die Art im Jahr 1929 durch Henry Fairfield Osborn. Nur wenige Jahre später verwies Osborn die Art zu einer eigenen Gattung unter der Bezeichnung Platelephas, was aber nicht anerkannt ist.[170][171][15]
Von der malaiischen Inselwelt sind noch einzelne andere Formen bekannt. Dazu gehört Elephas hysudrindicus, das vor allem auf Java nachgewiesen wurde. Hier bildet die Form einen Teil der bedeutenden Kedung-Brubus-Fauna aus dem Übergang vom Unteren zum Mittleren Pleistozän. Die Art geht auf Eugène Dubois aus dem Jahr 1908 zurück, der das zugrunde liegende Fossilmaterial aber nicht vorstellte.[172] Dies tätigten erst nachfolgende Autoren.[171][173][174] In einzelnen Merkmalen zeigt Elephas hysudrindicus Mischmerkmale zwischen Elephas hysudricus und Elephas maximus. Dies betrifft unter anderem die im Vergleich zu ersterem mit 18 bis 21 höhere Lamellenanzahl (Lamellenfrequenz 6,5) und den moderat dicken Zahnschmelz, in Bezug auf letzteren beispielsweise den voluminöseren Schädel. Aufgrund dessen wird Elephas hysudrindicus in der Regel nicht in die direkte Vorgängerschaft des heutigen Asiatischen Elefanten gestellt.[15] Als eher problematisch ist „Elephas“ celebensis einzuschätzen. Ursprünglich im Jahr 1949 durch Dirk Albert Hooijer anhand einzelner Zahnfunde aus dem Unteren und Mittleren Pleistozän von Sulawesi als Archidiskodon celebensis benannt,[175] wurde die Art später mehrheitlich zu Elephas verwiesen. Aufgrund der Größe der Zähne repräsentiert sie eine Zwergform, die nur die Hälfte der Ausmaße von Elephas planifrons erreichte. Nur ein Jahr nach Hooijer führte Miklós Kretzoi mit Stegoloxodon indonesicus eine weitere Zwergform von Java ebenfalls basierend auf Zahnfunden ein.[176] Diese galt späteren Autoren als synonym zu „Elephas“ celebensis. Als markante Auffälligkeit ist die mittlere Aufwölbung der Zahnschmelzfalten zu erachten, die sich ähnlich in den Zähnen der Afrikanischen Elefanten wiederfindet. Die Anzahl der Zahnschmelzfalten auf dem letzten Molaren liegt bei 8 bis 11.[15][177] Neuere Studien aus dem Jahr 2008 tendieren dazu, die Gattung Stegoloxodon als eigenständig zu betrachten und neben Stegoloxodon indonesicus auch „Elephas“ celebensis darin einzureihen.[178] Unklar ist die zeitliche Stellung und phylogenetische Zugehörigkeit von Elephas beyeri, eine verzwergte Form, die im Jahr 1956 anhand eines einzelnen Zahnes von der philippinischen Insel Cabarruyan vor Luzon beschrieben worden war. Der Erstbeschreiber Gustav Heinrich Ralph von Koenigswald sah aufgrund der Lamellenfrequenz die größte Ähnlichkeit zu „Elephas“ namadicus, womit die Form eigentlich zur Gattung Palaeoloxodon gehören würde.[179][177][180]
Im Vergleich zu den recht reichhaltigen Funden stammesgeschichtlich älterer Vertreter der Gattung Elephas sind Reste des Asiatischen Elefanten fossil nur selten belegt. Ein einzelner hinterer Backenzahn aus dem nordindischen Bundesstaat Jammu und Kaschmir mit mehr als 22 Schmelzfalten und einer Kronenhöhe mehr als doppelt so groß wie die Kronenweite könnte auf die Anwesenheit der Art bereits im Mittleren Pleistozän hinweisen.[181] Der weitaus umfangreichere Teil der Funde gehört dem Oberen Pleistozän an und ist weit gestreut über den indischen Subkontinent. Hervorgehoben werden können die Reste aus den Flusstälern des Narmada oder des Godavari. Ebenso liegen einzelne Fossilien aus Sri Lanka vor, so vom Fluss Ratnapura im Süden des Inselstaates.[182][166] Vor allem isolierte Zähne kamen des Weiteren auf der Malaiischen Halbinsel zu Tage. Ihr Alter ist zumeist ungeklärt, wahrscheinlich gehören sie in den Übergang vom Oberen Pleistozän zum Holozän.[183] Aus dem südlichen China sind mehrere Fossilreste dokumentiert, so unter anderem aus den Höhlen von Quzai und Baxian in der Autonomen Region Guangxi. Hier kam der Asiatische Elefant im Verlauf des Oberpleistozäns sympatrisch mit Vertretern der Gattung Stegodon vor. Nach Isotopenanalysen war Stegodon stärker auf weiche Pflanzenkost spezialisiert, der Asiatische Elefant dagegen ernährte sich als Generalist sowohl von weicher als auch harter Pflanzenkost. Demnach teilten sich beide Rüsseltierformen kein gemeinsames Habitat, da erstere eher dichte Wälder bevorzugte, letztere hingegen auch in offeneren Landschaften auftrat.[184]
Forschungsgeschichte

Die wissenschaftliche Benennung des Asiatischen Elefanten geht auf Linnaeus aus dem Jahr 1758 zurück. In seinem bedeutenden Werk Systema Naturae führte Linnaeus die Elefanten Afrikas und Asiens unter der Bezeichnung Elephas maximus und gab als Typuslokalität Ceylonae, das heutige Sri Lanka, an.[185] Die Bezeichnung Elephas ist griechischer Herkunft (έλέφας) mit weitgehend unbekanntem Ursprung. Eventuell entstammt sie dem hebräischen Wort ibah, welches über das Sanskrit (ibhas) vermittelt wurde und sich auch im lateinischen Wort ebur für „Elfenbein“ wiederfindet. Verwendet wurde Elephas schon in antiker Zeit, bezog sich damals aber weniger auf das Tier selbst als vielmehr auf die Stoßzähne beziehungsweise das Elfenbein.[186] Als übergeordnete Bezeichnung für alle Elefanten ist Elephas bereits bei John Ray im Jahr 1693 zu finden, auf den sich Linnaeus auch in seinem Systema Naturae berief.[187] Die formale Trennung zwischen den asiatischen und den afrikanischen Elefanten vollzog Johann Friedrich Blumenbach im Jahr 1797 in seinem „Handbuch der Naturgeschichte“, hierin führte er erstere unter Elephas asiaticus, letztere untere Elephas africanus. Seinen Schritt begründete Blumenbach mit Unterschieden im Zahnbau.[188][189][171]
In einer späteren Publikation über die Sammlung des schwedischen Königs Adolf Friedrich in Stockholm aus dem Jahr 1764 verwies Linnaeus auf einen in Alkohol eingelegten Embryo als Grundlage für die Aufstellung der Art Elephas maximus.[190] Das Exemplar war bereits zuvor von Albert Seba in seinem Werk Thesaurus erwähnt und abgebildet worden, es stellte lange Zeit das Typusexemplar der Art dar. Seba hatte dessen Herkunft allerdings mit Afrika angegeben.[191] Genetische Untersuchungen an dem Individuum aus dem Jahr 2014 ermittelten eine tatsächliche Herkunft aus Afrika und identifizierten es als Afrikanischen Elefanten. Die Autoren der Studie wählten daher ein nahezu vollständiges Skelett, aufgestellt im Museum La Specola in Florenz, als Lectotypen des Asiatischen Elefanten aus (Exemplarnummer MZUF-734). Dieses hatte bereits bei John Ray 1693 Erwähnung gefunden und ließ sich sowohl morphologisch als auch genetisch eindeutig dem Asiatischen Elefanten zuordnen. Vermutlich handelt es sich um den historisch belegten Elefanten „Hansken“, der 1630 auf Ceylon, dem heutigen Sri Lanka, geboren wurde und 1655 in Florenz verstarb.[192]
Linnaeus hatte bereits wenige Jahre vor seiner Erstbenennung den Asiatischen Elefanten mit dem Namen Elephas indicus belegt. Seine Urheberschaft dafür ist aber nach den Regeln des ICZN nicht gültig. Die Artzuweisung wurde von anderen Autoren der damaligen Zeit teils fortgeführt, so unter anderem von Georges Cuvier im Jahr 1798. Cuvier unterschied wie Blumenbach ein Jahr zuvor den Asiatischen Elefanten als Elephas indicus vom Afrikanischen, für den er die Bezeichnung Elephas capensis wählte (eine heutige Synonymbezeichnung zu Loxodonta africana). Cuvier gab zwar kein Herkunftsgebiet für Elephas indicus an, doch etablierte er damit die heutige Unterartenbezeichnung für die Festlandsformen des Asiatischen Elefanten.[193] Im Verlauf des 19. Jahrhunderts wurde der Name Elephas indicus fast ausschließlich für den Asiatischen Elefanten gebraucht. Dies änderte sich erst 1891 mit dem Hinweis William Thomas Blanfords auf die Priorität von Elephas maximus.[194] Für die Inselformen von Sumatra prägte nahezu 50 Jahre später Coenraad Jacob Temminck den Namen Elephas sumatranus.[195]
Asiatischer Elefant und Mensch
Lokale kulturelle Aspekte und Zähmung

Als größtes Landsäugetier des asiatischen Kontinents fand der Asiatische Elefant früh Einzug in die kulturellen Traditionen der Menschen. Frühe bildliche Darstellungen entstanden bereits im Jungpaläolithikum und finden sich unter anderem an der Jwalapuram-Lokalität bei Kurnool 180 km südlich von Hyderabad im zentralen Indien. Die an einer Felswand angebrachte, rötlich gehaltene Elefantendarstellung ist 1,7 m lang und 1,2 m hoch und bildet Teil eines Ensembles von mehreren zoomorphen Gestalten. Die Felsmalerei datiert in den Zeitraum zwischen 20.000 und 11.000 Jahren vor heute.[196][197] Bereits mesolithischer Zeitstellung sind einzelne Jagdszenen im Vindhyagebirge bei Mirzapur, so nahe der Wyndham-Fälle oder Morhana Pahar, im nördlichen Indien.[198] Die Zähmung des Asiatischen Elefanten setzte dahingegen deutlich später ein, wann diese aber genau begann, ist weitgehend ungeklärt. Möglicherweise sprechen Gravierungen auf Siegeln der Indus-Kultur im Tal des Indus für eine bereits frühe Zähmung und Nutzung der Tiere. Die Indus-Kultur entfaltete sich im Zeitraum von 2600 bis 1900 v. Chr. und steht in der Tradition der Bronzezeit. Die Anzahl der Siegel mit Elefantenmotiven geht aber gegenüber anderen Darstellungen stark zurück, aus den beiden großen Städten Mohenjo-Daro und Harappa liegen insgesamt weniger als 50 vor.[199] Zu diesem Zeitpunkt kam es aber auch zum Handel mit Elfenbein und daraus hergestellten Kunstobjekten, wie etwa Funde aus der Siedlung Gonur Depe (Turkmenistan) der nördlich benachbarten Oasenkultur angeben.[200]
Spätestens nach dem Untergang der Indus-Kultur und dem Beginn der vedischen Zeit um 1500 v. Chr. muss der Asiatische Elefant auf dem indischen Subkontinent gezähmt worden sein. Klassische Literatur wie das Rig Veda aus dem 15. Jahrhundert. v. Chr., die Upanischaden aus dem 9. bis 6. Jahrhundert v. Chr. und das Gaja-śāstra (Sanskrit für „Elefantenkunde“) aus dem 6. bis 5. Jahrhundert v. Chr. dokumentieren Details über Fang, Schulung und Haltung von Elefanten. Neben dem Gaja-śāstra beschäftigten sich auch einige andere Sanskrit-Werke eindringlich mit den Elefanten, etwa das Arthaśāstra und das Mātanga-līlā. Zu diesem Zeitpunkt unterschieden die Inder verschiedene Kasten des Asiatischen Elefanten, so die stattlichen Koomeriah, die langsamen und eher schwachen Manda, die schlaksigen und nervösen Meerga und einen Mischtyp Miśra genannt (in einem Drei-Kasten-System wurden diese unter Koomeriah, Meerga und Dvásalain geführt).[201][20][158] Die Tiere wurden hauptsächlich bei Rodungen eingesetzt, um Bäume zu fällen und Holz aus den Lichtungen zu tragen. Sie hatten dadurch eine wichtige Funktion bei der Errichtung von Siedlungen. Ob sie auch damals schon in den Krieg einbezogen wurden, ist unklar. Erst Megasthenes, im ausgehenden 4. Jahrhundert v. Chr. als griechischer Diplomat am Hof von Chandragupta Maurya, berichtet in seinem Werk Indika von angeblich 9000 Elefanten in der Armee des Maurya-Reiches. Die Schrift gibt darüber hinaus Einblick in die Zähmung und in Krankheiten der Tiere.[202] Zum Umgang mit den Arbeitselefanten bildete sich eine eigenständige Berufsgruppe heraus, die Mahouts. Diese speziellen Elefantentrainer und -führer haben eine enge und teils jahrzehntelange Bindung zu ihren jeweiligen Tieren. Die Tradition wird bis heute in der Regel in der Familie weitergegeben. Langjährig geschulte Elefanten können zwischen 20 und 30 Kommandoworte befolgen, hinzu kommen verschiedene taktile Anweisungen.[203][204]
Von Indien aus breitete sich die Kenntnis der Zähmung des Asiatischen Elefanten über Süd- und Südostasien aus. Die Bedeutung des Asiatischen Elefanten auf dem indischen Subkontinent und in Südostasien drückt sich vor allem in seiner religiösen Bedeutung aus. Dies belegen beispielsweise der elefantengesichtige Gott Ganesha, der weiße Elefant Airavata als Reittier des Gottes Indra beziehungsweise Gajendra als Diener des Gottes Vishnu im hinduistischen Glauben oder die Zeugungs- und Geburtslegende von Siddharta Gautama der buddhistischen Tradition.[205] Der Asiatische Elefant fand so unter anderem Eingang in die Tempelarchitektur, wie einige herausragende Beispiele etwa die rund 360 m lange Terrasse der Elefanten oder das Elefantentor in Angkor, errichtet während des Khmer-Königreichs von 9. bis 14. Jahrhunderts, angeben. Erwähnenswert sind auch die Sandakada pahana, sogenannte „Mondsteine“, die als halbkreisförmige Strukturen im Eingangsbereich einen wichtigen Aspekt der singhalesischen Architektur während der Anuradhapura- und Polonnaruwa-Epoche vom 4. Jahrhundert v. Chr. bis zum 13. Jahrhundert n. Chr. darstellen.[206][207] Bis heute leben außerdem in hinduistischen und buddhistischen Tempeln Indiens und Sri Lankas Tempelelefanten, die in Ritualen, Prozessionen und großen religiösen Festivals mitwirken. Im 14. und 15. Jahrhundert während der Herrschaft der Timuriden oder während des Mogulreiches ab dem 16. Jahrhundert diente der Asiatische Elefant häufig zur Darstellung imperialer Größe.[208]

In der westlichen Welt wurde der Asiatische Elefant relativ spät bekannt. Aus altägyptischer Zeit liegen zwar einzelne Darstellungen von Elefanten wie in der Grabkapelle des Rechmire in Theben-West aus dem 15. Jahrhundert v. Chr. vor, die aufgrund der kleinen Ohren den Asiatischen Elefanten als Vorbild annehmen lassen, auch erlegte Pharao Thutmosis III. nach der Schlacht von Mittani um 1446 v. Chr. auf dem Heimweg laut Überlieferung bis zu 120 Elefanten,[209][160] exakte Beschreibungen der Tiere kamen aber nicht vor der griechisch-römischen Antike auf. Bereits Homer erwähnte in seinen beiden Epen Ilias und Odyssee Elefanten, bezieht sich aber weitgehend nur auf das Elfenbein beziehungsweise die Stoßzähne. Im Jahr 416 v. Chr. beschrieb dann der griechische Gelehrte Ktesias von Knidos erstmals einen Asiatischen Elefanten am Hof des persischen Großkönigs Dareios II. Während der Schlacht von Gaugamela um 331 v. Chr. gegen den persischen König Dareios III. oder in der Schlacht am Hydaspes um 326 v. Chr. gegen den indischen König Poros, erfuhren die Makedonier erstmals von der Effizienz der persischen und indischen Kriegselefanten. Für letztere Schlacht ist der Einsatz einer großen Phalanx von 200 Kriegselefanten dokumentiert. Alexander der Große sah dies als Anlass, eine eigene Streitmacht aus Elefanten aufzubauen. Er fing über ein Dutzend Tiere ein, was wiederum Aristoteles die Möglichkeit gab, die Tiere genauer zu studieren. Aristoteles setzte sich in seinen Werken De partibus animalium und Historia animalium mehrfach mit den Elefanten auseinander, dabei erkannte er die Bedeutung und Funktion des Rüssels, ebenso auch, dass ein Tier ohne diesen nicht überleben würde.[210][211][212] Während der Diadochenkriege in der Nachfolge des Todes von Alexander des Großen fiel Perdikkas mit dessen Elefanten in Ägypten ein und wurde von Ptolemaios I. besiegt. Die Ptolemäer übernahmen Alexanders Asiatische Elefanten und ersetzten sie später durch Afrikanische, die sie im Raum des heutigen Eritrea einfingen. Die Zähmungsversuche des Afrikanischen Elefanten seitens der Ptolemäer gipfelten schlussendlich in der Schlacht bei Raphia um 217 v. Chr. gegen die Seleukiden. Da sich bei dieser Kriegshandlung Asiatische und Afrikanische Elefanten auf der gegnerischen Seite gegenüberstanden, wird sie teilweise auch als „Schlacht der Elefanten“ bezeichnet.[213][214] Im weiteren Verlauf wurden Elefanten auch zu Vergnügungs- und Repräsentationszwecken eingesetzt. Berühmt ist die Einweihung des von Gnaeus Pompeius Magnus beauftragten ersten steinernen Theaters in Rom im Jahr 55 v. Chr., bei der neben Nashörnern und verschiedenen Raubtieren auch 20 Elefanten geschlachtet wurden.[215] Ähnlich den verschiedenen Reichen in Mittel- und Südasien hatte der Asiatische Elefant während der europäischen Kolonialzeit der Portugiesen, Niederländer und Engländer ab dem 15./16. Jahrhundert häufig repräsentativen Charakter, einzelne Tiere wurden als diplomatische Geschenke weitergegeben. Erwähnt seien hier etwa die Elefanten „Hanno“ als Geschenk an Papst Leo X. und „Soliman“ als Geschenk an Maximilian, dem späteren Kaiser Maximilian II. des Heiligen Römischen Reiches Deutscher Nation.[208]
Bedrohung und Schutz

Wie bei seinem afrikanischen Verwandten ist auch beim Asiatischen Elefanten die Jagd einer der größten Bedrohungsfaktoren für den Bestand der Art. Die Jagd konzentriert sich dabei nicht nur auf das Elfenbein, sie erfolgt auch aufgrund des Fleisches, das als Nahrungsressource dient, und der Haut, die vielfältig genutzt wird. Untersuchungen zum tatsächlichen Grad der Bedrohung liegen nur wenige vor. Nach einer 20-jährigen Studie im Periyar-Nationalpark im südlichen Indien von 1974 bis 1994 wurden in dem Zeitraum schätzungsweise mehr als 3 t Elfenbein illegal erbeutet. Die massive Jagd führte dazu, dass sich das Geschlechtsverhältnis von männlichen zu weiblichen Tieren von 1:6 auf 1:122 verschob. Infolgedessen ging nicht nur die Anzahl der Bullen absolut zurück, auch sank das Verhältnis stoßzahntragender zu stoßzahnlosen Tieren relativ, ebenso wie sich die Größe der Stoßzähne je Individuum verringerte.[216] Vergleichbare Entwicklungstrends sind auch für andere indische Schutzgebiete veröffentlicht worden.[28] Für andere Regionen im Verbreitungsgebiet des Asiatischen Elefanten ist die Datenlage eher gering. Laut einer Studie wurden zwischen den Jahren 2010 und 2015 in Myanmar über 60 Elefanten illegal getötet, allein im Jahr 2016 starben im südzentralen Teil des Landes 19 Tiere, darunter sieben, die zu einer mit Radiosendern ausgestatteten Studiengruppe gehörten.[217] Auf Sumatra wurden in der zweiten Hälfte der 2000er Jahre insgesamt 44 Elefanten getötet. Einzelne Populationen im südlichen Teil der Insel, etwa im Nationalpark Way Kambas, gelten als nicht überlebensfähig.[218][219]
Neben illegaler Jagd und Wilderei haben die Zerstörung und Zersiedelung des Lebensraums sowie Umwandlung in wirtschaftliche Nutzflächen einen negativen Einfluss auf die Bestände. Das Verbreitungsgebiet des Asiatischen Elefanten deckt sich mit einer der am dichtesten durch den Menschen besiedelten Weltregion. Der durch die Größe der Tiere und durch ihre soziale Lebensweise verursachte hohe Platz- und Nahrungsbedarf führt in vielen dicht besiedelten und/oder landwirtschaftlich genutzten Gebieten Südasiens zu Mensch-Tier-Konflikten, die wiederum die Zerstörung von Feldern, Häusern oder auch den Verlust von Menschenleben zur Folge haben.[220] Für ganz Indien wurden im Zeitraum von 1991 bis 2001 etwa 150–230 Tote pro Jahr registriert.[221] In Sri Lanka sterben zwischen 30 und 70 Menschen jährlich bei Zusammenstößen mit Elefanten, allein in den Jahren 2004 bis 2005 kam es im südöstlichen Teil des Inselstaates zu 975 registrierten Konflikten. In Bangladesch wiederum verloren in den Jahren 2001 und 2002 etwa 38 Menschen ihr Leben, während in Vietnam allein im Jahr 2002 etwa 26 Menschen an einem Ort durch Elefanten getötet wurden. In der dicht besiedelten Provinz Lampung im Süden Sumatras werden für den Zeitraum 2000 bis 2002 über 700 Konflikte mit drei getöteten Personen angegeben, für den Zeitraum 2005 bis 2010 liegen Informationen über fünf getötete Menschen vor.[222][223][219] Die Reduktion und Vermeidung derartiger Konflikte stellt eine der größten Herausforderungen der lokalen und überregionalen Naturschutzgruppen dar. Konfliktlösungen finden sich in verschiedenen Herangehensweisen, die von physischen Barrieren (Zäune, Gräben) über Abschreckung (Feuer, Lärm, Pufferzonen mit ungenießbaren Pflanzen) bis hin zu Umsiedlungen oder Keulungen von Elefantenherden reichen.[223][5][16]


Schätzungen für die wildlebende Population des Asiatischen Elefanten reichen von 48.320 bis 51.680 Individuen. Die Daten wurden im Jahr 2018 erhoben, werden aber teilweise als zweifelhaft angesehen. Gut die Hälfte davon entfällt auf Indien, für die anderen rund ein Dutzend Staaten, in denen der Asiatische Elefant beheimatet ist, schwanken die Daten zwischen 70 und 250 Individuen (etwa China, Vietnam und Bangladesch) bis zu 2500 und 5000 Individuen (etwa Sri Lanka, Myanmar oder Thailand).[16][223][26] Daneben gibt es noch etwa 14.500 bis 16.000 gezähmte Tiere. Auch hier ist die Anzahl recht unterschiedlich verteilt, für Myanmar wird sie auf rund 6000 beziffert, für Laos auf rund 480. Die Fortpflanzungsrate der Tiere in Gefangenschaft ist aber eher gering, was zum Erlöschen der domestizierten Bestände führen kann. Daher müssen allein in Myanmar zur Aufrechterhaltung der Anzahl jährlich rund 100 Individuen aus der freien Wildbahn als Nachschub beschafft werden. Diese Praxis resultiert in einer zusätzlichen Bedrohung der wildlebenden Populationen.[223][224] Seitens von Naturschutzaktivisten – unter anderem der thailändischen Elefantenschützerin Lek Chailert und ihrer Save Elephant Foundation[225] oder der indischen Tier- und Elefantenschutz-Organisation Wildlife SOS,[226] – wird kritisiert, dass domestizierte Elefanten grundsätzlich der brutalen traditionellen Zähmungsmethode des „Phajaan“ unterworfen wurden/werden, die dazu dient, die Tiere geistig zu brechen und gefügig zu machen. Dabei werden Elefantenbabys gewaltsam von ihren Müttern getrennt, gefesselt und geschlagen, bis sie aufgeben – wenn sie sich zu sehr wehren, kommt es vor, dass Tiere dabei sterben.[227][228] Auch später kommt weiterhin der traditionelle Elefantenhaken zum Einsatz, durch den viele Elefanten Verletzungen an Kopf oder Körper davontragen.[229][230] Es steht des Weiteren die oft nicht artgerechte Haltung der gezähmten Tiere in Kritik, die einerseits traditionell in der Holzwirtschaft Schwerstarbeit verrichten müssen oder als Tempel- und Prozessionselefanten dienen, oft an extrem kurzen Ketten auf Beton stehen müssen und in einigen Ländern Südostasiens für touristische Zwecke eingesetzt werden, etwa das Reiten, das „Straßenbetteln“[229] und in Zirkussen – fast alle entsprechenden Tiere sind körperlich massiv überarbeitet und/oder psychisch traumatisiert, nicht selten unterernährt,[231][229][230] in schweren Fällen sogar behindert oder blind.[232][233][234][235] Nach einzelnen wissenschaftlichen Studien bestehen jedoch Möglichkeiten einer Kombination aus Tier- und Artenschutz sowie menschlicher Freizeitgestaltung.[236]
Insgesamt geht die IUCN für die wildlebenden Bestände des Asiatischen Elefanten von einem generell abnehmenden Trend aus, Erhebungen zufolge betrug die Reduktion in den letzten drei Elefanten-Generationen (je 20 bis 25 Jahre) rund 50 %. Der Rückgang ist verbunden mit dem Lebensraumverlust und der Minderung der Habitateigenschaften. Die Naturschutzorganisation stuft die Art daher als „bedroht“ (endangered) ein. Maßnahmen zu ihrem Erhalt bestehen im Schutz des Lebensraumes einschließlich der Schaffung von Migrationswegen beziehungsweise -korridoren, in der Lösung von Mensch-Tier-Konflikten sowie in einem besseren Schutz der Tiere unter anderem durch Handelsverbote und einer Stärkung der lokalen und internationalen Gesetzgebung.[16] Der Asiatische Elefant ist im Anhang I des Washingtoner Artenschutz-Übereinkommens gelistet. Damit verpflichten sich die Vertragsstaaten, den überregionalen und internationalen Handel sowie grenzüberschreitenden Transfer von lebenden Exemplaren und Teilen toter Tiere zu verbieten und nur unter Ausnahmegenehmigungen nationaler Behörden zu gestatten.[237][5] Für die Mitgliedstaaten der Europäischen Union wurde das durch Aufnahme in Anhang A der EU-Artenschutzverordnung umgesetzt, womit hier etwa auch die Ein- oder Ausfuhr, das Zurschaustellen oder Vorrätighalten zu kommerziellen Zwecken oder Kauf- oder Verkaufsangebote mit oder ohne internationalen Bezug verboten sind.[238]
Literatur
- Ronald M. Nowak: Walker’s Mammals of the World. Johns Hopkins University Press, Baltimore (MD), 1999, ISBN 0-8018-5789-9.
- Jeheskel Shoshani und John F. Eisenberg: Elephas maximus. Mammalian Species 182, 1982, S. 1–8.
- G. Wittemyer: Family Elephantidae. In: Don E. Wilson und Russell A. Mittermeier (Hrsg.): Handbook of the Mammals of the World. Volume 2: Hooved Mammals. Lynx Edicions, Barcelona 2011, S. 50–79 (S. 78–79), ISBN 978-84-96553-77-4.
Einzelnachweise
- ↑ Fred Kurt und Janac C. Kumarasinghe: Remarks on body growth and phenotypes in Asian elephant Elephas maximus. Acta Theriologica Suppl. 5, 1998, S. 135–153
- ↑ N. G. Pillai: On the height and age of an elephant. Journal of the Bombay Natural History Society 42, 1941, S. 927–928 ([1])
- ↑ Jeheskel Shoshani: On the Dissection of a Female Asian Elephant (Elephas maximus maxiums Linnaeus, 1758) and Data from Other Elephants. Elephant 2 (1), 1982, S. 3–93
- ↑ a b c d e f g h i j k l m n o p q Jeheskel Shoshani und John F. Eisenberg: Elephas maximus. Mammalian Species 182, 1982, S. 1–8
- ↑ a b c d e f g h i j k l m n G. Wittemyer: Family Elephantidae. In: Don E. Wilson und Russell A. Mittermeier (Hrsg.): Handbook of the Mammals of the World. Volume 2: Hooved Mammals. Lynx Edicions, Barcelona 2011, S. 50–79 (S. 78–79) ISBN 978-84-96553-77-4
- ↑ R. I. Pocock: Notes on the Asiatic Elephant (Elephas maximus). Annals and Magazine of Natural History 10 (11), 1943, S. 273–280
- ↑ a b Earl of Cranbrook, J. Payne und Charles M. U. Leh: Origin of the elephants Elephas maximus L. of Borneo. Sarawak Museum Journal 63, 2007, S. 95–125
- ↑ a b c Nancy E. Todd: Qualitative Comparison of the Cranio-Dental Osteology of the Extant Elephants, Elephas Maximus (Asian Elephant) and Loxodonta africana (African Elephant). The Anatomical Record 293, 2010, S. 62–73
- ↑ J. Jayewardene: The elephant in Sri Lanka. Wildlife Heritage Trust of Sri Lanka, Colombo, 1994
- ↑ Fred Kurt, Günther B. Hartl und Ralph Tiedemann: Tuskless bulls in Asian elephants Elephas maximus. History and populationgenetics of a man-made phenomenon. Acta Theeriologica Suppl. 3, 1995, S. 125–143
- ↑ a b Shermin de Silva, Ashoka D. G. Ranjeewa und Devaka Weerakoon: Demography of Asian elephants (Elephas maximus) at Uda Walawe National Park, Sri Lanka based on identified individuals. Biological Conservation 144, 2011, S. 1742–1752
- ↑ Shane C. Cambell-Staton, Brian J. Arnold, Dominique Conçalves, Petter Granli, Joyce Poole, Ryan A. Long und Robert M. Pringle: Ivory poaching and the rapid evolution of tusklesness in African elephants. Science 374, 2021, S. 483–487, doi:10.1126/science.abe7389
- ↑ Asier Larramendi: Estimating tusk masses in proboscideans: a comprehensive analysis and predictive model. Historical Biology, 2023, doi:10.1080/08912963.2023.2286272
- ↑ V. L. Roth und Jeheskel Shoshani: Dental identification and age determination in Elephas maximus. Journal of Zoology 214, 1988, S. 567–588
- ↑ a b c d e f g Vincent J. Maglio: Origin and Evolution of the Elephantidae. Transactions of the American Philosophical Society 63 (3), 1973, S. 1–149 (S. 31–50)
- ↑ a b c d e f g h i C. Williams, S. K. Tiwari, V. R. Goswami, S. de Silva, A. Kumar, N. Baskaran, K. Yoganand und V. Menon: Elephas maximus. The IUCN Red List of Threatened Species 2008. e.T7140A12828813 ([2]); zuletzt abgerufen am 26. März 2021
- ↑ A. Calabrese, J. M. Calabrese, M. Songer, M. Wegmann, S. Hedges, R. Rose und P. Leimgruber: Conservation status of Asian elephants: the influence of habitat and governance. Biodiversity and Conservation 26 (9), 2017, S. 2067–2081, doi:10.1007/s10531-017-1345-5
- ↑ a b Stephen Blake und Simon Hedges: Sinking the Flagship: the Case of Forest Elephants in Asia and Africa. Conservation Biology 18 (5),2004, S. 1191–1202
- ↑ Andrew T. Smith und Yan Xie: A Guide to the Mammals of China. Princeton University Press, 2008, S. 156–157, ISBN 978-0-691-09984-2
- ↑ a b R. Sukumar: The Asian Elephant: Ecology and Management. Zweite Ausgabe, Cambridge University Press, 1993, ISBN 0-521-43758-X ([3])
- ↑ a b R. Sukumar und Charles Santiapillai: Elephas maximus: status and distribution. In: Jeheskel Shoshani und Pascal Tassy (Hrsg.): The Proboscidea. Evolution and palaeoecology of the Elephants and their relatives. Oxford, New York, Tokyo, 1996, S. 327–331
- ↑ Anwaruddin Choudhury: Status and conservation of the Asian Elephant Elephas maximus in north‐eastern India. Mammal Review 29 (3), 1999, S. 141–174
- ↑ T. N. C. Vidya, P. Fernando, D. J. Melnick und R. Sukumar: Population differentiation within and among Asian elephant (Elephas maximus) populations in southern India. Heredity 94, 2005, S. 71–80 ([4])
- ↑ a b c N. Baskaran, Surendra Varma, C. K. Sar und Raman Sukumar: Current status of Asian elephant in India. Gajah 35, 2017, S. 47–54
- ↑ Charles Santiapillai, Zhu Xiang, Dong Yong Hua und Sheng Qin Zhong: Distribution of elephant in Xishuangbanna Dai Autonomous Prefecture, China. Gajah 12, 1994, S. 34–45
- ↑ a b Li Zhang, Lu Dong, Liu Lin, Limin Feng, Fan Yan, Lanxin Wang, Xianming Guo und Aidong Luo: Asian Elephants in China: Estimating Population Size and Evaluating Habitat Suitability. PLoS ONE 10 (5), 2015, S. e0124834, doi:10.1371/journal.pone.0124834
- ↑ a b Geir Steinheim, Per Wegge, Jo I. Fjellstad, Shant R. Jnawali und Robert B. Weladji: Dry season diets and habitat use of sympatric Asian elephants (Elephas maximus) and greater one-horned rhinoceros (Rhinocerus unicornis) in Nepal. Journal of Zoology 265, 2005, S. 377–385
- ↑ a b H. N. Kumara, S. Rathnakumar, M. Ananda Kumar und M. Singh: Estimating Asian elephant, Elephas maximus, density through distance sampling in the tropical forests of Biligiri Rangaswamy Temple Tiger Reserve, India. Tropical Conservation Science 5 (2), 2012, S. 163–172
- ↑ a b c d e f g h i j k l m George M. McKay: Behavior and Ecology of the Asiatic Elephant in Southeastern Ceylon. Smithsonian Contributions to Zoology 125, 1973, S. 1–113
- ↑ Denise E. Lukacs, Melanie Poulin, Hayley Besenthal, Otto C. Fad, Stephen P. Miller, James L. Atkinson und Esther J. Finegan: Diurnal and Nocturnal Activity Time Budgets of Asian Elephants (Elephas maximus) in a Zoological Park. Animal Behavior and Cognition 3 (2), 2016, S. 63–77
- ↑ a b M. Ananda. Kumar und M. Singh: Behavior of Asian Elephant (Elephas maximus) in a Land-Use Mosaic: Implications for Human-Elephant Coexistence in the Anamalai Hills, India. Wildlife Biology in Practice 6 (2), 2010, S. 69–80
- ↑ A. M. Riyas Ahamed: Activity Time Budget of the Asian Elephant (Elephas maximus Linn.) in the Wild. Trends in Biosciences 8 (12), 2015, S. 3024–3028
- ↑ W. M. P. Samarasinghe und A. M. Riyas Ahamed: A Preliminary study on Activity Budgets of Asian Elephant (Elephas maximus Linn.) at Elephant Orphanage. Bulletin of Environment, Pharmacology and Life Sciences 5 (7), 2016, S. 47–50
- ↑ Irene Tobler: Behavioral sleep in the Asian elephant in captivity. Sleep 15 (1), 1992, S. 1–12
- ↑ Nadine Gravett, Adhil Bhagwandin, Robert Sutcliffe, Kelly Landen, Michael J. Chase, Oleg I. Lyamin, Jerome M. Siegel und Paul R. Manger: Inactivity/sleep in two wild free-roaming African elephant matriarchs – Does large body size make elephants the shortest mammalian sleepers? PLoS ONE 12 (3), 2017, S. e0171903, doi:10.1371/journal.pone.0171903
- ↑ a b Helena Stokes, Vijitha B. V. P. Perera, Nilmini Jayasena und Ayona Silva‐Fletcher: Nocturnal behavior of orphaned Asian elephant (Elephas maximus) calves in Sri Lanka. Zoo Biology 36 (4), 2017, S. 261–272
- ↑ Nicole M. Weissenböck, Walter Arnold und Thomas Ruf: Taking the heat: thermoregulation in Asian elephants under different climatic conditions . Journal of Comparative Physiology B 182 (2), 2012, S. 311–319, doi:10.1007/s00360-011-0609-8
- ↑ Robin C. Dunkin, Dinah Wilson, Nicolas Way, Kari Johnson und Terrie M. Williams: Climate influences thermal balance and water use in African and Asian elephants: physiology can predict drivers of elephant distribution. The Journal of Experimental Biology 216, 2013, S. 2939–2952
- ↑ Rukmali Athurupana, Dennis Schmitt und Charles Santiapillai: Pinnae movement of captive Asian elephants weakly affected by environmental factors. Gajah 43, 2015, S. 4–9
- ↑ N. Ishwaran: Comparative study of Asiatic elephant Elephas maximus populations in Gal Oya, Sri Lanka. Biological Consertation 21, 1981, S. 303–313
- ↑ P. Fernando und Russell Lande: Molecular genetic and behavioral analysis of social organization in the Asian elephant (Elephas maximus). Behavioral Ecology and Sociobiology 48 (1), 2000, S. 84–91
- ↑ T. N. C.Vidya und R. Sukumar: Social organization of the Asian elephant (Elephas maximus) in southern India inferred from microsatellite DNA. Journal of Ethology 23, 2005, S. 205–210
- ↑ Shermin de Silva, Ashoka D. G. Ranjeewa und Sergey Kryazhimskiy: The dynamics of social networks among female Asian elephants. BMC Ecology 11, 2011, S. 17 ([5])
- ↑ Shermin de Silva und George Wittemyer: A Comparison of Social Organization in Asian Elephants and African Savannah Elephants. International Journal of Primatology 33 (5), 2012, S. 1125–1141
- ↑ Shermin de Silva, Volker Schmid und George Wittemyer: Fission–fusion processes weaken dominance networks of female Asian elephants in a productive habitat. Behavioral Ecology 28 (1), 2017, S. 243–252
- ↑ a b c d e John F. Eisenberg, George M. McKay und M. R. Jainudeen: Reproductive behavior of the Asiatic elephant (Elephas maximus maximus L.). Behaviour 38 (3/4), 1971, S. 193–225
- ↑ Nagarajan Baskaran, R. Kanakasabai und Ajay A. Desai: Influence of Ranging and Hierarchy on the Habitat Use Pattern by Asian Elephant (Elephas maximus) in the Tropical Forests of Southern India. In: C. Sivaperuman und K. Venkataraman (Hrsg.): Indian Hotspots. Springer Nature, 2018, S. 345–358
- ↑ Raman Sukumar: Ecology of the Asian Elephant in Southern India. I. Movement and Habitat Utilization Patterns. Journal of Tropical Ecology 5 (1), 1989, S. 1–18
- ↑ M. Ananda Kumar, Divya Mudappa und T. R. Shankar Raman: Asian elephant Elephas maximus habitat use and ranging in fragmented rainforest and plantations in the Anamalai Hills, India. Tropical Conservation Science 3 (2), 2010, S. 143–158
- ↑ Hemant S. Datye und A. M. Bhagwat: Home range of elephants in fragmented habitats of central India. Journal of the Bombay Natural History Society 92, 1995, S. 1–10 ([6])
- ↑ Prithiviraj Fernando, Eric D. Wikramanayake, H. K. Janaka, L. K. A. Jayasinghe, Manori Gunawardena, Sarath W. Kotagama, Devaka Weerakoon und Jennifer Pastorini: Ranging behavior of the Asian elephant in Sri Lanka. Mammalian Biology 73, 2008, S. 2–13
- ↑ a b Raymond Alfred, Abd Hamid Ahmad, Junaidi Payne, Christy Williams, Laurentius Nayan Ambu, Phua Mui Ho und, Benoit Goossens: Home Range and Ranging Behaviour of Bornean Elephant (Elephas maximus borneensis) Females. PLoS ONE 7 (2), 2012, S. e31400, doi:10.1371/journal.pone.0031400
- ↑ Michael Stüwe, Jasmi B. Abdul, Burhanuddin Mohd. Nor und Christen M. Wemmer: Tracking the movements of translocated elephants in Malaysia using satellite telemetry. Oryx 32, 1998, S. 68–74
- ↑ Arham Bahar, Nur Hidayah Abu Kasim und Kamarul Hambali: Home range and movement patterns of Asian elephant (Elephas maximus) in Gua Musang, Kelantan, Malaysia. Malayan Nature Journal 70 (2), 2018, S. 221–232
- ↑ a b Ritesh Joshi: Asian Elephant’s Elephas maximus Behaviour in the Rajaji National Park, North-West India: Eight Years with Asian Elephant. Nature and Science 7 (1), 2009, S. 49–77
- ↑ Radhika Makecha, Otto Fad und Stan A. Kuczaj II: The Role of Touch in the Social Interactions of Asian Elephants (Elephas maximus). International Journal of Comparative Psychology 25, 2012, S. 60–82
- ↑ L. E. L. Rasmussen, M. J. Schmidt, R. Henneous, D. Groves und G. D. Daves Jr.: Asian bull elephants: flehmen-like responses to extractable components in female elephant estrous urine. Science 217, 1982, S. 159–162
- ↑ L. E. L. Rasmussen, Terry D. Lee, Wendell L. Roelofs, Aijun Zhang und G. Doyle Daves: Insect pheromone in elephants. Nature 379, 1996, S. 684
- ↑ Josef Lazar, David R. Greenwood, L. E. L. Rasmussen und Glenn D. Prestwich: Characterization of an odorant binding protein of the Asian elephant, Elephas maximus. Implications for the role of lipocallins in the mammalian olfaction. Biochemistry 41 (39), 2002, S. 11786–11794
- ↑ L. E. L. Rasmussen und B. Munger: The sensorineural specializations of the trunk tip (finger) of the Asian elephant (Elephas maximus). Anatomical Record 246, 1996, S. 127–134
- ↑ L. E. L. Rasmussen und B. A. Schulte: Chemical signals in the reproduction of Asian (Elephas maximus) and African (Loxodonta africana) elephants. Animal Reproduction Science 53, 1998, S. 19–34
- ↑ L. E. L. Rasmussen: Chemical communication: An integral part of functional Asian elephant (Elephas maximus) society. Ecoscience 5 (3), 1998, S. 410–426
- ↑ L. E. L. Rasmussen und D. R. Greenwood: Frontalin: a chemical message of musth in Asian elephants, Elephas maximus. Chemical Senses 28, 2003, S. 433–446
- ↑ Bruce A. Schulte, Kathryn Bagley, Maureen Correll, Amy Gray, Sarah M. Heineman, Helen Loizi, Michelle Malament, Nancy L. Scott, Barbara E. Slade, Lauren Stanley, Thomas E. Goodwin und L. E. L. Rasmussen: Assessing chemical communication in elephants. In: R. T. Mason, M. P. LeMaster und D. Müller-Schwarze (Hrsg.): Chemical Signals in Vertebrates 10. New York, 2005, S. 140–151
- ↑ L. E. L. Rasmussen, David R. Greenwood, Thomas E. Goodwin und Bruce A. Schulte: Asian Elephant Reflections: Chirality Counts. In: Bruce A. Schulte, Thomas E. Goodwin und Michael H. Ferkin (Hrsg.): Chemical Signals in Vertebrates 13. New York, 2016, S. 229–244
- ↑ Emily J. Polla, Cyril C. Grueter und Carolynn L. Smith: Asian Elephants (Elephas maximus) Discriminate Between Familiar and Unfamiliar Human Visual and Olfactory Cues. Animal Behavior and Cognition 5 (3), 2008, S. 279–291
- ↑ Josefin Arvidsson, Mats Amundin und Matthias Laska: Successful acquisition of an olfactory discrimination test by Asian elephants, Elephas maximus. Physiology & Behavior 105, 2012, S. 809–814
- ↑ Alisa Rizvanovic, Mats Amundin und Matthias Laska: Olfactory Discrimination Ability of Asian Elephants (Elephas maximus) for Structurally Related Odorants. Chemical Senses 38, 2013, S. 107–118
- ↑ C. E. O‘Connell-Rodwell, B. T. Arnason und L. A. Hart: Seismic properties of Asian elephant (Elephas maximus) vocalizations and locomotion. Journal of the Acoustic Society of America 108 (6), 2000, S. 3066–3072
- ↑ Michael A. Pardo, Joyce H. Poole, Angela S. Stoeger, Peter H. Wrege, Caitlin E. O’Connell-Rodwell, Udaha Kapugedara Padmalal und Shermin de Silva: Differences in combinatorial calls among the 3 elephant species cannot be explained by phylogeny. Behavioral Ecology 30 (3), 2019, S. 809–820, doi:10.1093/beheco/arz018
- ↑ Angela S. Stoeger und Shermin de Silva: African and Asian Elephant Vocal Communication: A Cross-Species Comparison. In: G. Witzany (Hrsg.): Biocommunication of Animals. Springer Science & Media Press, 2014, S. 21–39
- ↑ Katharine B. Payne, William R. Langbauer Jr. und Elizabeth M. Thomas: Infrasonic calls of the Asian elephant (Elephas maximus). Behavioral Ecology and Sociobiology 18, 1986, S. 297–301
- ↑ Smita Nair, Rohini, Chandra Sekhar Seelamantula und Sukumar: Vocalizations of wild Asian elephants (Elephas maximus): Structural classification and social context. Journal of the Acoustic Society of America 126, 2009, S. 2768–2778
- ↑ Shermin de Silva: Acoustic communication in the Asian elephant, Elephas maximus maximus. Behaviour 147, 2010, S. 825–852
- ↑ Astrid Herler und Angela S. Stoeger: Vocalizations and associated behaviour of Asian elephant (Elephas maximus) calves. Behaviour 149 (6), 2012, S. 575–599
- ↑ Angela S. Stoeger, Daniel Mietchen, Sukhun Oh, Shermin de Silva, Christian T. Herbst, Soowhan Kwon und W. Tecumseh Fitch: An Asian Elephant Imitates Human Speech. Current Biology 22, 2012, S. 2144–2148
- ↑ Angela S. Stoeger und Paul Manger: Vocal learning in elephants: neural bases and adaptive context. Current Opinion in Neurobiology 28, 2014, S. 101–107
- ↑ Paul A. Rees: Asian elephants (Elephas maximus) dust bathe in response to an increase in environmental temperature. Journal of Thermal Biology 27, 2002, S. 353–358
- ↑ Bernhard Rensch und Rudolf Altevogt: Zähmung und Dressurleistungen indischer Arbeitselefanten. Zeitschrift für Tierpsychology 11 (3), 1954, S. 497–510
- ↑ Moti Nissani, Donna Hoefler-Nissani, U Tin Lay und U Wan Htun: Simultaneous visual discrimination in Asian elephants. Journal of the experimental Analysis of Behavior 83 (1). 2005, S. 15–29
- ↑ Moti Nissani: Elephant Cognition: A Review of Recent Experiments. Gajah 28, 2008, S. 44–52
- ↑ Naoko Irie und Toshikazu Hasegawa: Summation by Asian Elephants (Elephas maximus). Behavioral Sciences 2, 2012, S. 50–56, doi:10.3390/bs2020050
- ↑ Naoko Irie, Mariko Hiraiwa‑Hasegawa und Nobuyuki Kutsukake: Unique numerical competence of Asian elephants on the relative numerosity judgment task. Journal of Ethology 37, 2019, S. 111–115, doi:10.1007/s10164-018-0563-y
- ↑ Joshua M. Plotnik, Daniel L. Brubaker, Rachel Dale, Lydia N. Tiller, Hannah S. Mumby und Nicola S. Clayton: Elephants have a nose for quantity. PNAS 116 (25), 2019, S. 12566–12571, doi:10.1073/pnas.1818284116
- ↑ Joshua M. Plotnik, Rachael C. Shaw, Daniel L. Brubaker, Lydia N. Tiller und Nicola S. Clayton: Thinking with their trunks: elephants use smell but not sound to locate food and exclude nonrewarding alternatives. Animal Behaviour 88, 2014, S. 91–98, doi:10.116/j.anbehav.2013.11.011
- ↑ Joshua M. Plotnik, Frans B. M. de Waal und Diana Reiss: Self-recognition in an Asian elephant. PNAS 103 (45), 2006, S. 17053–17057
- ↑ Joshua M. Plotnik, Frans B. M. de Waal, Donald Moore III und Diana Reiss: Self-Recognition in the Asian Elephant and Future Directions for Cognitive Research With Elephants in Zoological Settings. Zoo Biology 28, 2009, S. 1–13
- ↑ Daniel J. Povinelli: Failure to Find Self-Recognition in Asian Elephants (Elephas maximus) in Contrast to Their Use of Mirror Cues to Discover Hidden Food. Journal of Comparative Psychology 103 (2), 1989, S. 122–131
- ↑ Rachel Dale und Joshua M. Plotnik: Elephants know when their bodies are obstacles to success in a novel transfer task. Scientific Reports 7, 2017, S. 46309, doi:10.1038/srep46309
- ↑ Kaori Mizuno, Naoko Irie, Mariko Hiraiwa-Hasegawa und Nobuyuki Kutsukake: Asian elephants acquire inaccessible food by blowing. Animal Cognition 19 (1), 2016, S. 215–222, doi:10.1007/s10071-015-0929-2
- ↑ a b Joshua M. Plotnik and Frans B. M. de Waal: Asian elephants (Elephas maximus) reassure others in distress. PeerJ 2, 2014, S. e278, doi:10.7717/peerj.278
- ↑ a b c d Ritesh Joshi, Rambir Singh, Raju Pushola und M. S. Negi: Reproductive behaviour of wild Asian Elephants Elephas maximus in the Rajaji National Park, North-West India. Researcher 1 (5), 2009, S. 77–84
- ↑ Joshua M. Plotnik, Richard Lair, Wirot Suphachoksahakun und Frans B. M. de Waal: Elephants know when they need a helping trunk in a cooperative task. PNAS 108 (12), 2011, S. 5116–5121, doi:10.1073/pnas.1101765108
- ↑ Ritesh Joshi: How social are Asian elephants Elephas maximus? New York Science Journal 3 (1), 2010, S. 27–31
- ↑ a b c d Raman Sukumar: Ecology of the Asian elephant in Southern India: II. Feeding habits and crop raiding patterns. Journal of Tropical Ecology 6, 1990, S. 33–53
- ↑ a b c d Nagarajan Baskaran, M. Balasubramanian, S. Swaminathan und Andajaya Desai: Feeding ecology of the Asian elephant Elephas maximus in the Nilgiri Biosphere Reserve, Southern India. Journal of the Bombay Natural History Society, 107 (1), 2010, S. 3–13
- ↑ a b Raj Kumar Koirala, David Raubenheimer, Achyut Aryal, Mitra Lal Pathak und Weihong Ji: Feeding preferences of the Asian elephant (Elephas maximus) in Nepal. BMC Ecology 16, 2016, S. 54, doi:10.1186/s12898-016-0105-9
- ↑ J. Borah und K. Deka. Nutritional Evaluation of Forage Preferred by Wild Elephants in the Rani Range Forest, Assam, India. Gajah 28, 2008, S. 41–43
- ↑ a b Dipak Das: Food and feeding habits of Asian elephants Elephas maximus in tropical deciduous forest of Tripura and its conservation. Bioscience Discovery 8 (4), 2017, S. 846–852
- ↑ a b Chen Jin, Deng Xiaobao, Zhang Ling und Bai Zhilin: Diet composition and foraging ecology of Asian elephants in Shangyong, Xishuangbanna, China. Acta Ecologica Sinica 26 (2), 2006, S. 309–316
- ↑ a b K. A. P. Samansiri und Devaka K. Weerakoon: Feeding Behaviour of Asian Elephants in the Northwestern Region of Sri Lanka. Gajah 27, 2007, S. 27–34
- ↑ a b Arnold F. Sitompul, Curtis R. Griffin und Todd K. Fuller: Diurnal activity and food choice of free-foraging captive elephants at the Seblat Elephant Conservation Center, Sumatra, Indonesia. Gajah 38, 2013, S. 19–24
- ↑ Shiori Yamamoto-Ebina, Salman Saaban, Ahimsa Campos-Arceiz und Seiki Takatsuki: Food habits of Asian elephants Elephas maximus in a rainforest of northern Peninsular Malaysia. Mammal Study 41, 2016, S. 155–161
- ↑ G. Vanaraj: Observations on debarking of trees by elephants in Biligiri Rangaswamy Temple Wildlife Sanctuary, Karnataka. Zoo’s Print Journal 16 (05), 2001, S. 484–486
- ↑ B. W. B. Vancuylenberg: Feeding behaviour of the Asiatic elephant in South-East Sri Lanka in relation to conservation. Biological Conservation 12, 1977, S. 33–55
- ↑ Randolph C. Morris: Elephants eating earth. The Journal of the Bombay Natural History Society 36 (1), 1932, S. 496–497 ([7])
- ↑ Edward Pollard: Asian Elephants in the Seima Biodiversity Conservation Area, Mondulkiri, Cambodia. Gajah 27, 2007, S. 52–55
- ↑ Hannah S. Mumby, Alexandre Courtiol, Khyne U. Mar und Virpi Lummaa: Birth seasonality and calf mortality in a large population of Asian elephants. Ecology and Evolution 3 (11), 2013, S. 3794–3803
- ↑ M. R. Jainudeen, J. F. Eisenberg und N. Tilakeratne: Oestrus cycle of the Asiatic elephant, Elephas maximus, in captivity. Journal of Reproduction and Fertility 27, 1971, S. 321–328
- ↑ David Hess, Anne M. Schmidt und Michael J. Schmidt: Reproductive Cycle of the Asian Elephant (Elephas maximus) in Captivity. Biology of Reproduction 38, 1983, S. 767–773
- ↑ J. L. Brown, D. L. Schmitt, A. Bellem, L. H. Graham und J. Lehnhardt: Hormone Secretion in the Asian Elephant (Elephas maximus): Characterization of Ovulatory and Anovulatory Luteinizing Hormone Surges. Biology of Reproduction 61, 1999, S. 1294–1299
- ↑ a b Barbara E. Slade-Cain, L. E. L. Rasmussen und Bruce A. Schulte: Estrous State Influences on Investigative, Aggressive, and Tail Flicking Behavior in Captive Female Asian Elephants. Zoo Biology 27, 2008, S. 167–180
- ↑ C. A. Niemuller und R. M. Liptrap: Altered androstenedione to testosterone ratios and LH concentrations during musth in the captive male Asian elephant (Elephas maximus). Journal of Reproduction and Fertility 91, 1991, S. 139–146
- ↑ M. R. Jainudeen, C. B. Katongole und R. V. Short: Plasma testosterone levels in relation to musth and sexual activity in the male Asian elephant (Elaphas maximus). Journal of Reproduction and Fertility 29, 1972, S. 99–103
- ↑ M. R. Jainudeen, G. M. McKay und J. F. Eisenberg: Observations on musth in the domesticated Asiatic elephant (Elaphas maximus). Mammalia 36, 1972, S. 247–261
- ↑ G. A. Lincoln und W. D. Ratnasooriya: Testosterone secretion, musth behaviour and social dominance in captive male Asian elephants living near the equator. Journal of Reproduction and Fertility 108, 1996, S. 107–113
- ↑ P. Keerthipriya, S. Nandini, Hansraj Gautam, T. Revathe und T. N. C. Vidya: Musth and its effects on male–male and male–female associations in Asian elephants. Journal of Mammalogy 101 (1), 2020, S. 259–270, doi:10.1093/jmammal/gyz190
- ↑ Karpagam Chelliah und Raman Sukumar: The role of tusks, musth and body size in male-male competition among Asian elephants, Elephas maximus. Animal Behaviour 86 (6), 2013, S. 1207–1214
- ↑ Karpagam Chelliah und Raman Sukumar: Interplay of male traits, male mating strategies and female mate choice in the Asian elephant, Elephas maximus. Behaviour 152, 2015, S. 1113–1144
- ↑ a b c P. G. A. Pushpakumara, R. C. Rajapakse, B. M. A. O. Perera und J. L. Brown: Reproductive performance of the largest captive Asian elephant (Elephas maximus) population in Sri Lanka. Animal Reproduction Science 174, 2016, S. 93–99
- ↑ Rekha Sharma und K. V. Krishnamurthy: Behavior of a neonate elephant (Elephas maximus). Applied Animal Behaviour Science 13, 1984/1985, S. 157–161
- ↑ R. Sukumar, N. V. Joshi und V. Krishnamurthy: Growth in the Asian elephant. Proceedings of the Indian Academy of Science (Animal Science) 97, 1988, S. 561–571
- ↑ a b c Shermin de Silva, C. Elizabeth Webber, U. S. Weerathunga, T. V. Pushpakumara, Devaka K. Weerakoon und George Wittemyer: Demographic Variables for Wild Asian Elephants Using Longitudinal Observations. PLoS ONE 8 (12), 2013, S. e82788, doi:10.1371/journal.pone.0082788
- ↑ Hannah S. Mumby, Alexandre Courtiol, Khyne U. Mar und Virpi Lummaa: Climatic variation and age-specific survival in Asian elephants from Myanmar. Ecology 94 (5), 2013, S. 1131–1141
- ↑ John F. Eisenberg: Ecolog y and Behavior of the Asian Elephant. Elephant 1 (5suppl.), 1980, S. 36–56
- ↑ HAGR: An Age entry for Elephas maximus. zuletzt abgerufen am 12. November 2018 ([8])
- ↑ A. J. T. Johnsingh: Large mammalian prey-predators in Bandipur. The Journal of the Bombay Natural History Society 80 (1), 1983, S. 496–497 ([9])
- ↑ Sanjeev Kumar: Attack on Elephant by Tiger, A Choice of food or Struggle for Survival, Ecological Study in Corbett Tiger Reserve, Ramnagar and Uttarakhand, India. International Journal of Life Sciences Scientific Research 2 (4), 2016, S. 506–508
- ↑ Vivek Thuppil und Richard G. Coss: Wild Asian elephants distinguish aggressive tiger and leopard growls according to perceived danger. Biology Letters 9, 2013, S. 20130518, doi:10.1098/rsbl.2013.0518
- ↑ Rudolf Schenkel und Ernst M. Lang: Das Verhalten der Nashörner. In: J. G. Helmcke, D. Starck und H. Wemuth (Hrsg.): Handbuch der Zoologie. 10 (25), 1969, S. 1–56
- ↑ a b T. N. C. Vidya und R. Sukumar: The effect of some ecological factors on the intestinal parasite loads of the Asian elephant (Elephas maximus) in southern India. Journal of Bioscience 27 (5), 2002, S. 521–528
- ↑ V. Vanitha, K. Thiyagesan und N. Baskaran: Prevalence of intestinal parasites among captive Asian Elephants Elephas maximus: effect of season, host demography, and management systems in Tamil Nadu, India. Journal of Threatened Taxa 3 (2), 2011, S. 1527–1534
- ↑ a b Carly L. Lynsdale, Diogo J. Franco dos Santos, Adam D. Hayward, Khyne U. Mar, Win Htut, Htoo Htoo Aung, Aung Thura Soe und Virpi Lummaa: A standardised faecal collection protocol for intestinal helminth egg counts in Asian elephants, Elephas maximus. International Journal for Parasitology: Parasites and Wildlife 4, 2015, S. 307–315
- ↑ a b Rizwar, Darmi, Dioba Wansir und Dina Mardianti: Ecto and endoparasites on Sumatran elephant population at Seblat Elephant training center, Bengkulu Province, Indonesia. Journal of Advances Zoology 38 (2): 2017, S. 178–185
- ↑ Milit G. Watwe und R. Sukumar: Asian elephants with longer tusks have lower parasite loads. Current Science 72 (11), 1997, S. 885–889
- ↑ H. Rahman, P. K. Dutta und J. N.Dewan: Foot- and Mouth disease in elephant (Elephas maximus). Journal of Veterinary Medicine B 35 (1), 1988, S. 70–71
- ↑ Hisashi Matsubayashi, Peter Lagan und Jum Rafiah Abd. Sukor: The use of Macaranga trees by the Asian elephants (Elephas maximus) in Borneo. Mammal Study 31, 2006, S. 115–118
- ↑ N. M. B. Pradhan, P. Wegge und S. R. Moe: How does a re-colonizing population of Asian elephants affect the forest habitat? Journal of Zoology 273 (2), 2007, S. 183–191
- ↑ Ahimsa Campos-Arceiz, Asier R. Larrinaga, Udayani R. Weerasinghe, Seiki Takatsuki, Jennifer Pastorini, Peter Leimgruber, Prithiviraj Fernando und Luis Santamaria: Behavior rather than diet mediates seasonal differnces in seed dispersal by Asian elephants. Ecology 89 (10), 2008, S. 2684–2691
- ↑ Ahimsa Campos-Arceiz und Steve Blake: Megagardeners of the forest – the role of elephants in seed dispersal. Acta Oecologia 37, 2011, S. 542–553
- ↑ Nagarajan Baskaran und Ajay Desai: Frugivory and seed dispersal by the Asian Elephant Elephas maximus in the tropical forests of Nilgiri Biosphere Reserve, southern India. Journal of Threatened Taxa 5 (14), 2013, S. 4893–4897
- ↑ Franziska K. Harich, Anna C. Treydte, Joseph O. Ogutu, John E. Roberts, Chution Savini, Jan M. Bauer und Tommaso Savini: Seed dispersal potential of Asian elephants. Acta Oecologica 77, 2016, S. 1–57
- ↑ Ahimsa Campos-Arceiz: Shit happens (to be useful)! Use of elephant dung as habitat by amphibians. Biotropica 41, 2009, S. 406–407
- ↑ Steven G. Platt, David P. Bickford, Myo Min Win und Thomas R. Rainwater: Water-filled Asian elephant tracks serve as breeding sites for anurans in Myanmar. Mammalia 83 (3), 2019, S. 287–289, doi:10.1515/mammalia-2017-0174
- ↑ a b Matthias Meyer, Eleftheria Palkopoulou, Sina Baleka, Mathias Stiller, Kirsty E. H. Penkman, Kurt W. Alt, Yasuko Ishida, Dietrich Mania, Swapan Mallick, Tom Meijer, Harald Meller, Sarah Nagel, Birgit Nickel, Sven Ostritz, Nadin Rohland, Karol Schauer, Tim Schüler, Alfred L Roca, David Reich, Beth Shapiro und Michael Hofreiter: Palaeogenomes of Eurasian straight-tusked elephants challenge the current view of elephant evolution. eLife 6, 2017, S. e25413, doi:10.7554/eLife.25413
- ↑ Jeheskel Shoshani und Pascal Tassy: Family Elephantidae Elephants. In: Jonathan Kingdon, David Happold, Michael Hoffmann, Thomas Butynski, Meredith Happold und Jan Kalina (Hrsg.): Mammals of Africa Volume I. Introductory Chapters and Afrotheria. Bloomsbury, London, 2013, S. 176–178
- ↑ Evgeny I. Rogaev, Yuri K. Moliaka1, Boris A. Malyarchuk, Fyodor A. Kondrashov, Miroslava V. Derenko, Ilya Chumakov und Anastasia P. Grigorenko: Complete Mitochondrial Genome and Phylogeny of Pleistocene Mammoth Mammuthus primigenius. PLoS Biology 4 (3), 2006, S. e73, doi:10.1371/journal.pbio.0040073
- ↑ Nadin Rohland, Anna-Sapfo Malaspinas, Joshua L. Pollack, Montgomery Slatkin, Paul Matheus und Michael Hofreiter: Proboscidean Mitogenomics: Chronology and Mode of Elephant Evolution Using Mastodon as Outgroup. PLoS Biology 5 (8), 2007, S. e207, doi:10.1371/journal.pbio.0050207
- ↑ Nadin Rohland, David Reich, Swapan Mallick, Matthias Meyer, Richard E. Green, Nicholas J. Georgiadis, Alfred L. Roca und Michael Hofreiter: Genomic DNA Sequences from Mastodon and Woolly Mammoth Reveal Deep Speciation of Forest and Savanna Elephants. PLoS Biology 8 (12), 2010, S. e1000564, doi:10.1371/journal.pbio.1000564
- ↑ Jeheskel Shoshani und Pascal Tassy: Advances in proboscidean taxonomy & classification, anatomy & physiology, and ecology & behavior. Quaternary International 126–128, 2005, S. 5–20
- ↑ a b Jeheskel Shoshani: Taxonomy, Classification, and Evolution of Elephants. In: M. E. Fowler und S. K. Mikota (Hrsg.) Biology, medicine, and surgery of elephants. Wiley-Blackwell, 2006, S. 3–14, ISBN 0-8138-0676-3 ([10])
- ↑ a b Linus Girdland-Flink, Ebru Albayrak und Adrian M. Lister: Genetic Insight into an Extinct Population of Asian Elephants (Elephas maximus) in the Near East. Open Quaternary 4 (2), 2018, S. 1–9, doi:10.5334/oq.36
- ↑ Prithiviraj Fernando, Michael E. Pfrender, Sandra E. Encalada und Russell Lande: Mitochondrial DNA variation, phylogeography and population structure of the Asian elephant. Heredity 84, 2000, S. 362–372
- ↑ Robert C. Fleischer, Elizabeth A. Perry, Kasinathan Muralidharan, Ernest E. Stevens und Christen M. Wemmer: Phylogeography of the Asian Elephant (Elephas maximus) based on mitochondrial DNA. Evolution 55 (9), 2001, S. 1882–1892
- ↑ Joerns Fickel, Dietmar Lieckfeldt, Parntep Ratanakorn und Christian Pitra: Distribution of haplotypes and microsatellite alleles among Asian elephants (Elephas maximus) in Thailand. European Journal of Wildlife Research 53, 2007, S. 298–303
- ↑ T. N. C. Vidya, Raman Sukumar und Don J. Melnick: Range-wide mtDNA phylogeography yields insights into the origins of Asian elephants. Proceedings of the Royal Society B 276, 2009, S. 893–902
- ↑ Sri Sulandari und Moch. Syamsul Arifin Zein: Mitochondrial DNA variation of the Sumatran Elephant populations in Sumatera, Indonesia. Biotropia 19 (2), 2012, S. 92–102
- ↑ a b T. N. C. Vidya: Evolutionary History and Population Genetic Structure of Asian Elephants in India. Indian Journal of History of Science 51.2.2, 2016, S. 391–405
- ↑ a b Robert T. Hatt: The Mammals of Iraq. Miscellaneous Publications Museum of Zoology, University of Michigan 106, 1959, S. 1–113 (S. 52–53) ([11])
- ↑ a b Canan Çakırlar und Salima Ikram: „When elephants battle, the grass suffers.“ Power, ivory and the Syrian elephant. Levant 48 (2), 2016, S. 167–183
- ↑ Prithiviraj Fernando, T. N. C. Vidya, John Payne, Michael Stuewe, Geoffrey Davison, Raymond J. Alfred, Patrick Andau, Edwin Bosi6, Annelisa Kilbourn und Don J. Melnick: DNA Analysis Indicates That Asian Elephants Are Native to Borneo and Are Therefore a High Priority for Conservation. PLoS Biology 1 (1), 2003, S. 110–115, doi:10.1371/journal.pbio.0000006
- ↑ Reeta Sharma, Benoit Goossens, Rasmus Heller, Rita Rasteiro, Nurzhafarina Othman, Michael W. Bruford und Lounès Chikhi: Genetic analyses favour an ancient and natural origin of elephants on Borneo. Scientific Reports 8, 2018, S. 880, doi:10.1038/s41598-017-17042-5
- ↑ William J. Sanders, Emmanuel Gheerbrant, John M. Harris, Haruo Saegusa und Cyrille Delmer: Proboscidea. In: Lars Werdelin und William Joseph Sanders (Hrsg.): Cenozoic Mammals of Africa. University of California Press, Berkeley, London, New York, 2010, S. 161–251
- ↑ Som Nath Kundal, Gyan Bhadur und Sandeep Kumar: Elephas cf. E. planifrons (Elephantidae, Mammalia) from Upper Siwalik Subgroup of Samba district, Jammu and Kashmir, India. Vertebrata Palasiatica 55 (1), 2017, S. 59–70
- ↑ S. S. Gupta und B. C. Verma: Stratigraphy and vertebrate fauna of the Siwalik Jammu District Group, Mansar-Uttarbaini section, J & K. Journal of thePalaeontological Society of India, 33, 1988, S. 117–124
- ↑ a b G. L. Badam und A. R. Sankhyan: Evolutionary Trends in Narmada Fossil Fauna. In: Anek R. Sankhyan (Hrsg.): Asian Perspectives on Human Evolution. New Delhi, 2009, S. 89–99
- ↑ Adrian M. Lister, Wendy Dirks, Amnon Assaf, Michael Chazan, Paul Goldberg, Yaakov H. Applbaum, Nathalie Greenbaum und Liora Kolska Horwitz: New fossil remains of Elephas from the southern Levant: Implications for the evolutionary history of the Asian elephant. Palaeogeography, Palaeoclimatology, Palaeoecology 386, 2013, S. 119–130
- ↑ Hugh Falconer und Proby Thomas Cautley: Fauna antiqua Sivalensis. British Museum. London, 1845–1849 ([12])
- ↑ Richard Lydekker: Catalogue of the fossil Mammalia in the British Museum (Natural History), Part IV. London, 1886, S. 1–233 (S. 98–107 und 116–122) ([13])
- ↑ Henry Fairfield Osborn: New Eurasiatic and American Proboscideans. American Museum Novitates 393, 1929, S. 1–22
- ↑ a b c Henry Fairfield Osborn: Proboscidea: a monograph of the discovery, evolution, migration and extinction of the mastodonts and elephants of the world. Volume II. Stegodontoidea, Elephantoidea. New York, 1942, S. 805–1675 (S. 1302–1303, 1308–1311, 1358–1361) ([14])
- ↑ Eugène Dubois: Das geologische Alter der Kendeng- oder Trinil-Fauna. Tijdschrift van het Koninklijk Nederlandsch Aardrijkskundig Genootschap 2, 1908, S. 1235–1270
- ↑ Dirk Albert Hooijer: Fossil Proboscidea from the Malay Archipelago and the Punjab. Zoologische Verhandelingen 28, 1955, S. 1–146
- ↑ Hanwen Zhang, Thomas Pape und Adrian M. Lister: On the type material of Elephas hysudrindicus Dubois, 1908 (Mammalia, Proboscidea). Journal of Vertebrate Paleontology, 2018, doi:10.1080/02724634.2017.1425211
- ↑ Dirk Albert Hooijer: Pleistocene vertebrates from Celebes IV. Archidiskodon celebensis nov. spec. Zoologische Mededelingen 30, 1949, S. 205–226
- ↑ Miklós Kretzoi: Stegeloxodon nov. gen., a loxodonta elefántok esetleges ázsiai öse (Stegoloxodon nov. gen., a possible Asiatic ancestor of true loxodonts). Földtani Közlöny, 80, 1950, S. 405–408
- ↑ a b Gerrit D. van den Bergh: The Late Neogene elephantoid-bearing faunas of Indonesia and their palaeozoogeographic implications; a study of the terrestrial faunal succession of Sulawesi, Flores and Java, including evidence for early hominid dispersal east of Wallace’s Line. Scripta Geologica 117, 1999, S. 1–419 (S. 177–202, 335)
- ↑ Georgi N. Markov und Haruo Saegusa: On the validity of Stegoloxodon Kretzoi, 1950 (Mammalia: Proboscidea). Zootaxa 1861, 2008, S. 55–56
- ↑ G. H. R. von Koenigswald: Fossil mammals from the Philippines. Proceedings of the Fourth Far-Eastern Prehistory and the Anthropology Division of the 8th Pacific Science Congresses, Quezon City, 1956, S. 339–369
- ↑ Alexandra A. E. van der Geer, Gerrit D. van den Bergh, George A. Lyras, Unggul W. Prasetyo, Rokus Awe Due, Erick Setiyabudi und Hara Drinia: The effect of area and isolation on insular dwarf proboscideans. Journal of Biogeography 43 (8), 2016, S. 1656–1666, doi:10.1111/jbi.12743
- ↑ Yash Pal Kundal und Som Nath Kundal: Elephas cf. E. maximus indicus (Elephantidae, Mammalia) from the Post Siwalik deposits of Jammu Province, Jammu and Kashmir, India. Vertebrata Palasiatica 49 (3), 2011, S. 348–361
- ↑ Parth R. Chauhan: Large mammal fossil occurrences and associated archaeological evidence in Pleistocene contexts of peninsular India and Sri Lanka. Quaternary International 192, 2008, S. 20–42
- ↑ Lim Tze Tshen: Quaternary Elephas fossils from peninsular Malaysia: Historical overview and new material. The Raffles Bulletin of Zoology·29 (suppl.), 2013, S. 139–153
- ↑ Jiao Ma, Yuan Wang, Changzhu Jin, Yaowu Hu und Hervé Bocherens: Ecological flexibility and differential survival of Pleistocene Stegodon orientalis and Elephas maximus in mainland southeast Asia revealed by stable isotope (C, O) analysis. Quaternary Science Reviews 212, 2019, S. 33–44
- ↑ Carl von Linné: Systema naturae. 10. Auflage, 1758, Band 1, S. 33 ([15])
- ↑ Merlin Peris: A note on the etymology of „elephant“. Journal of the Royal Asiatic Society of Sri Lanka NS 38, 1993/1994, S. 163–168
- ↑ John Ray: Synopsis methodica animalium quadrupedium et serpentini generis. London, 1693, S. 1–336 (S. 131–142) ([16])
- ↑ Johann Friedrich Blumenbach: Handbuch der Naturgeschichte. Göttingen, 1797, S. 1–714 (S. 125) ([17])
- ↑ Glover M. Allen: Zoological results of the George Vanderbilt African Expedition of 1934. Part II: The forest elephant of Africa. Proceedings of the Academy of Natural Sciences of Philadelphia 88, 1936, S. 15–44
- ↑ Carl von Linné: Museum s:æ r:æ m:tis Ludovicæ Ulricæ reginæ svecorum, gothorum, vandalorumque. Salvius: Holmiae, 1764 ([18])
- ↑ Albert Seba: Locupletissimi rerum naturalium thesauri accurata descriptio et iconibus artificiosissimis expressio per universam physices historiam. Band I, Amsterdam, 1734, S. 175 und Tafel 111 ([19])
- ↑ Enrico Cappellini, Anthea Gentry, Eleftheria Palkopoulou, Yasuko Ishida, David Cram, Anna-Marie Roos, Mick Watson, Ulf S. Johansson, Bo Fernholm, Paolo Agnelli, Fausto Barbagli, D. Tim J. Littlewood, Christian D. Kelstrup, Jesper V. Olsen, Adrian M. Lister, Alfred L. Roca, Love Dalén und M. Thomas P. Gildert: Resolution of the type material of the Asian elephant, Elephas maximus Linnaeus, 1758 (Proboscidea, Elephantidae). Zoological Journal of the Linnean Society 170, 2014, S. 222–232
- ↑ Georges Cuvier: Tableau élémentaire de l’histoire naturelle des animaux. Paris, 1798, S. 1–710 (S. 148–149) ([20])
- ↑ William Thomas Blanford: Fauna of British India, including Ceylon and Burma. Mammalia. London, 1888–1891, S. 1–617 (S. 463–467) ([21])
- ↑ Coenraad Jacob Temminck: Coup-d’oeil general sur les possessions neerlandaises dans l’Inde archipelagique. Volume II. Leiden, 1847, S. 1–471 (S. 91) ([22])
- ↑ Chris Clarkson, Michael Petraglia, Ravi Korisettar, Michael Haslam, Nicole Boivin, Alison Crowther, Peter Ditchfield, Dorian Fuller, Preston Miracle, Clair Harris, Kate Connell, Hannah James und Jinu Koshy: The oldest and longest enduring microlithic sequence in India: 35 000 years of modern human occupation and change at the Jwalapuram Locality 9 rockshelter. Antiquity 83, 2009, S. 326–348
- ↑ Paul S. C. Taçon, Nicole Boivin, Jamie Hampson, James Blinkhorn, Ravi Korisettar und Michael Petraglia: New rock art discoveries in the Kurnool District, Andhra Pradesh, India. Antiquity 84, 2010, S. 335–350
- ↑ Ajay Pratap: Rock art of the Vindhyas: An archaeological survey. Archaeopress, 2016, S. 1–172
- ↑ Jonathan Mark Kenoyer: Indus seals: an overview of iconography and style. Ancient Sindh 9, 2006/2007, S. 7–30
- ↑ Dennys Frenez: Manufacturing and trade of Asian elephant ivory in Bronze Age Middle Asia. Evidence from Gonur Depe (Margiana, Turkmenistan). Archaeological Research in Asia 15, 2018, S. 13–33, doi:10.1016/j.ara.2017.08.002
- ↑ Franklin Edgerton: The Elephant-lore of the Hindus: The Elephant Sport (Matanga-lila) of Nilakantha. Motilal Banarsidass, Neu-Delhi, 1985 (Nachdruck von 1931), S. 1–129
- ↑ J. W. McCrindle: Ancient India As Described By Megasthenes and Arrian. London, 1877, S. 1–223 (S. 93–94 und S. 139) ([23])
- ↑ Bernhard Rensch und Rudolf Altevogt: Das Ausmaß visueller Lernfähigkeit eines Indischen Elefanten. Zeitschrift für Tierpsychology 12 (1), 1955, S. 68–76
- ↑ Lynette Hart und Sundar: Family traditions for Mahouts of Asian elephants. Anthrozoös 13 (1), 2000, S. 34–42
- ↑ Aayushi Verma und Ila Gupta: The journey of elephant as a decorative element in Saharanpur woodcraft: A cultural investigation. Bharatiya Pragna: An interdisciplinary Journal of Indian studies 1 (2), 2016, S. 38–44
- ↑ H. I. E. Katugaha: Elephants in stone. Gajah 20, 2001, S. 63–65
- ↑ Noel Hidalgo Tan: Elephants in South-East Asian Rock Art, an Overview. In: Anura Manatunga, K. A. T. Chamara, Thilina Wickramaarachchi und Harini Navoda de Zoysa (Hrsg.): International Conference on Asian Elephants in Culture & Nature, 20th – 21st August 2016. University of Kelaniya, Sri Lanka, 2016 (Abstracts)
- ↑ a b Raman Sukumar: The Human–Elephant Relationship through the Ages: A Brief Macro-Scale History. In: Piers Locke und Jane Buckingham (Hrsg.): Conflict, Negotiation, and Coexistence: Rethinking Human–Elephant Relations in South Asia. Oxford, 2016, doi:10.1093/acprof:oso/9780199467228.001.0001
- ↑ Diamantis Panagiotopoulos: Foreigners in Egypt in the Time of Hatshepsut and Thutmose III. In: E. H. Cline und D. O’Connor (Hrsg.): Thutmose III. A New Biography. Ann Arbor, 2006, S. 370–412
- ↑ Merlin Peris: Aristotle’s Notices on the Elephant. Gajah 22, 2003, S. 71–75
- ↑ Lionel Casson: Ptolemy II and the hunting of African elephants. Transactions of the American Philological Association 123, 1993, S. 247–260
- ↑ H. J. Gehrke: Alexander der Große. C. H. Beck, München, 1996, ISBN 3-406-41043-X ([24])
- ↑ Michael B. Charles: Elephant Size in Antiquity. DNA Evidence and the Battle of Raphia. Historia 65 (1), 2016, S. 54–65
- ↑ Pierre Schneider: Again on the elephants of Raphia: Re-examination of Polybius' factual accuracy and historical method in the light of a DNAsurvey. Histos 10, 2016, S. 132–148
- ↑ Jo-Ann Shelton: Elephants, Pompey, and the reports of popular displeasure in 55 BC. In: Shannon N. Byrne und Edmund P. Cueva (Hrsg.): Veritatis Amicitiaeque Causa: Essays in Honor of Anna Lydia Motto and John R. Clark. Wauconda, Illinois, 1999, S. 231–271
- ↑ R. Sukumar, Uma Ramakrishnan und J. A. Santosh: Impact of poaching on an Asian elephant population in Periyar, southern India: a model of demography and tusk harvest. Animal Conservation 1, 1998, S. 281–291
- ↑ Christie Sampson, John McEvoy, Zaw Min Oo, Aung Myo Chit, Aung Nyein Chan, David Tonkyn, Paing Soe, Melissa Songer, A. Christy Williams, Klaus Reisinger, George Wittemyer und Peter Leimgruber: New elephant crisis in Asia – Early warning signs from Myanmar. PLoS ONE 13 (3), 2018, S. e0194113, doi:10.1371/journal.pone.0194113
- ↑ Simon Hedges, Martin J. Tyson, Arnold F. Sitompul, Margaret F. Kinnairda, Donny Gunaryadi und Aslan: Distribution, status, and conservation needs of Asian elephants (Elephas maximus) in ampung Province, Sumatra, Indonesia. Biological Conservation 124, 2005, S. 35–48
- ↑ a b Wahdi Azmi und Donny Gunaryadi: Current Status of Asian Elephants in Indonesia. Gajah 35, 2011, S. 55–61
- ↑ K. Ullas Karanth und M. D. Madhusudan: Mitigating human-wildlife-conflicts in Southern Asia. In: John Terborgh, Carel van Schaik, Lisa Davenport und Madhu Rao (Hrsg.): Making parks work. Strategies for preserving tropical nature. Washington/Covelo/London, 2002, S. 250–264
- ↑ R. Sukumar: The Living Elephants: Evolutionary Ecology, Behaviour, and Conservation. Oxford University Press, 2003, S. 1–477 (S. 298–351)
- ↑ Ahimsa Campos-Arceiz, Seiki Takatsuki, Sampath K.K. Ekanayaka und Toshikazu Hasegawa: The Human-Elephant Conflict in Southeastern Sri Lanka: Type of Damage, Seasonal Patterns, and Sexual Differences in the Raiding Behavior of Elephants. Gajah 31, 2009, S. 5–14
- ↑ a b c d B. M. A. Oswin Perera: The Human-Elephant Conflict: A Review of Current Status and Mitigation Methods. Gajah 30, 2009, S. 41–52
- ↑ Ingrid Colette Suter, Gilles Pierre Maurer und Greg Baxter: Population viability of captive Asian elephants in the Lao PDR. Endangered Species Research 24, 2014, S. 1–7
- ↑ Save Elephant Foundation (englisch; Abruf am 27. Oktober 2023)
- ↑ Elephants, auf der Website von Wildlife SOS (englisch; Abruf am 12. Dezember 2023)
- ↑ Elefanten ihre Würde zurückgeben, Artikel auf der Website von Future for Elephants (Abruf am 27. Oktober 2023)
- ↑ Abschnitt Der Alptraum Phajaan, in: Thailand - SEF und ENP, Artikel auf der Website von Future for Elephants (Abruf am 27. Oktober 2023)
- ↑ a b c Neellohit Banerjee: What is a Begging Elephant?, auf der Website von Wildlife SOS (Indien), 22. April 2022 (englisch; Abruf am 12. Dezember 2023)
- ↑ a b Plight of captive Elephants und Roohi Narula: Is Pop Culture Hastening The Demise of Asian Elephants?, auf der Website von Wildlife SOS (Indien), 22. April 2022 (englisch; Abruf am 12. Dezember 2023)
- ↑ Meet Thailand's elephant whisperer, Luisa Garcia bei CBS News vom 7. Juni 2016, cbsnews.com
- ↑ Siehe z. B. die Biografie der Elefantin Medo, auf der Website der Save Elephant Foundation (englisch; Abruf am 27. Oktober 2023)
- ↑ Siehe die Biografie der Elefantin Kabu, auf der Website der Save Elephant Foundation (englisch; Abruf am 27. Oktober 2023)
- ↑ Siehe die Biografie der Elefantin Jokia, auf der Website der Save Elephant Foundation (englisch; Abruf am 27. Oktober 2023)
- ↑ Zu blinden Eleanten siehe auch: Mahima Sharma: Socialisation of rescued Elephants at Wildlife SOS, auf der Website von Wildlife SOS (Indien), 9. September 2021 (englisch; Abruf am 12. Dezember 2023)
- ↑ Pakkanut Bansiddhi, Janine L. Brown und Chatchote Thitaram: Welfare assessment and activities of captive elephants in Thailand. Animals 10, 2020, S. 919, doi:10.3390/ani.10060919
- ↑ CITES: Convention on International Trade in Endangered Species of Wild Fauna and Flora. Text of the Convention. (Article III: Regulation of Trade in Specimens of Species Included in Appendix I.) Signed at Washington, D.C., on 3 March 1973; Amended at Bonn, on 22 June 1979
- ↑ Artikel 4 Einfuhr, Artikel 5 Ausfuhr, Artikel 8 Abs. 1 Vermarktung, Art. 9 Beförderung der VO (EG) Nr. 338/97
Weblinks
- Elephas maximus in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: C. Williams, S. K. Tiwari, V. R. Goswami, S. de Silva, A. Kumar, N. Baskaran, K. Yoganand & V. Menon, 2019. Abgerufen am 26. März 2021.
- Video: Elephas maximus – Schritt. Institut für den Wissenschaftlichen Film (IWF) 1954, zur Verfügung gestellt von der Technischen Informationsbibliothek (TIB), doi:10.3203/IWF/E-1.
Auf dieser Seite verwendete Medien
(c) I, Sailko, CC BY 2.5
Skeleton hall, Museo di storia naturale sezione di zoologia La Specola, Florence, Italy.
Replik
Autor/Urheber: Vijayendrav05, Lizenz: CC BY-SA 4.0
The Indian elephant is one of three recognized subspecies of the Asian elephant and native to mainland Asia
Autor/Urheber: TobiasDornbusch, Lizenz: CC BY-SA 4.0
Herde Asiatischer Elefanten im Kaudulla Nationalpark, Sri Lanka. Es handelt sich um eine Gruppe weiblicher, miteinander verwandter Tiere, einschließlich noch nicht geschlechtsreifer, männlicher Nachkommen.
Zähne von Elephas_hysudricus aus der Erstbeschreibung von Hugh Falconer und Proby Thomas Cautley
Autor/Urheber: Herrick with Olympus C-220 Zoom, Lizenz: CC BY-SA 2.0 de
Asiatischer Elefant
Autor/Urheber: , Lizenz: CC BY-SA 4.0
Skeleton of Asian elephant, Elephas maximus Linnaeus, 1758, 3D model
Autor/Urheber: DagdaMor, Lizenz: CC BY-SA 4.0
Elefantenmolaren, oben: Loxodonta, Mitte: Elephas, unten: Mammuthus, fotographiert im Phyletischen Museum in Jena
Autor/Urheber: T. R. Shankar Raman, Lizenz: CC BY-SA 3.0
Seedling growing from elephant dung in the Anamalai Hills, India
Autor/Urheber: Dhruvaraj S, Lizenz: CC BY 2.0
Asian Elephant in Nagarhole National Park
Autor/Urheber: Z thomas, Lizenz: CC BY-SA 4.0
Elefantenbulle (Sri-Lanka-Elefant) im Kaudulla-Nationalpark in Sri Lanka
One of the famous "Victory coin of Alexander", minted in Babylon after Alexander's India campaigns.
Autor/Urheber: Adrita Ghosh 94, Lizenz: CC BY-SA 4.0
In kaziranga national park
Autor/Urheber: Rohitvarma, Lizenz: CC BY-SA 4.0
Took this image in minneriya national park when two elephants were engaged in friendly banter.
Autor/Urheber: Christie Sampson, Lizenz: CC BY-SA 4.0
Kadaver eines Elefanten (Reg.-Nr. 201601), der am 18. Mai 2016 auf einer Kautschukplantage in den südlichen Bago-Yoma-Bergen in Myanmar gefunden wurde
© Sémhur / Wikimedia Commons, CC BY-SA 4.0
Evolution of the distribution of Asian elephants (Elephas maximus)
Autor/Urheber: Cherubino, Lizenz: CC BY-SA 3.0
Elephas maximus maximus in Hurulu Eco Park
Autor/Urheber: UrLunkwill, Lizenz: CC BY-SA 3.0 de
Zwei Elefanten im Zoologischen Garten Berlin beim Sex.
(c) Diego Delso, CC BY-SA 3.0
Terrace of the Elephants, Angkor Thom, Cambodia
Autor/Urheber: E. Gilchrist, Lizenz: CC BY-SA 4.0
Physischer Kontakt zwischen Elefanten nach Notsituationen umfassen Berührungen der Genitalien, des Mundes oder des Kopfes (wie hier dargestellt) mit dem Rüssel, photographiert bei der Golden Triangle Asian Elephant Foundation, Chiang Rai, Thailand
Autor/Urheber: Die Autorenschaft wurde nicht in einer maschinell lesbaren Form angegeben. Es wird Bodenseemann als Autor angenommen (basierend auf den Rechteinhaber-Angaben)., Lizenz: CC BY-SA 2.5
Asian Elephant photographed in Jim Corbett National Park . March 2004.
Author: BodenseemannAutor/Urheber: World Imaging, Lizenz: CC BY-SA 3.0
Collection of seals of the Indus Valley Civilization. also showing Swastikas. British Museum.
Autor/Urheber: DagdaMor, Lizenz: CC BY 4.0
Schädel von Elephas maximus, links: seitliche Sicht, rechts: Blick von vorn; aufgenommen im Phyletisches Museum Jena, Deutschland
Schädel von Elephas planifrons aus der Erstbeschreibung von Hugh Falconer und Proby Thomas Cautley
Autor/Urheber: A. J. T. Johnsingh, WWF-India and NCF, Lizenz: CC BY-SA 4.0
A family group of elephants in Mudumalai Tiger Reserve, India
Autor/Urheber: Kabeerali bilal, Lizenz: CC BY-SA 4.0
I took this photo from Nagarhole Tiger Reserve, Karnataka, India
Autor/Urheber: N.A.Nazeer , Lizenz: CC BY-SA 4.0
Captive Elephants of Kerala, Cruelty against elephants, Aanapremam, Thrissur Pooram, Festivals of Kerala, Elephants in captivity, Temples of Kerala
Autor/Urheber: Muhammad Mahdi Karim, Lizenz: GFDL 1.2
A Bengal tiger in Bannerghatta National park in Bangalore
Autor/Urheber: Yathin S Krishnappa, Lizenz: CC BY-SA 3.0
Tusker debarking a tree in Kabini