Appel-Reaktion
Die Appel-Reaktion ist eine nukleophile Substitutionsreaktion vom Typ SN2, die in der organischen Chemie die Überführung von Alkoholen in die entsprechenden Alkylhalogenide ermöglicht. Bevorzugt werden dabei primäre und sekundäre Alkohole verwendet. Die Appel-Reaktion ist ein Spezialfall der Redox-Kondensation nach Mukaiyama.[1] Die Namensreaktion ist nach ihrem Entdecker Rolf Appel (1921–2012, Universität Bonn) benannt, der seine Forschungsergebnisse dazu ab 1975 veröffentlichte.
Übersichtsreaktion
Als Reagenzien werden stöchiometrische Mengen[2] von Triphenylphosphin (TPP = PPh3) und einem Tetrahalogenmethan, wie beispielsweise Tetrachlormethan (CCl4) oder Tetrabrommethan (CBr4) benötigt. Mit Tetrafluormethan (CF4) kann die Reaktion nicht durchgeführt werden.
Als Produkt entsteht bei der Appel-Reaktion aus einem Alkohol (R1 und R2 sind organische Reste) ein Halogenalkan, im Beispiel ein Chloralkan.
Reaktionsmechanismus
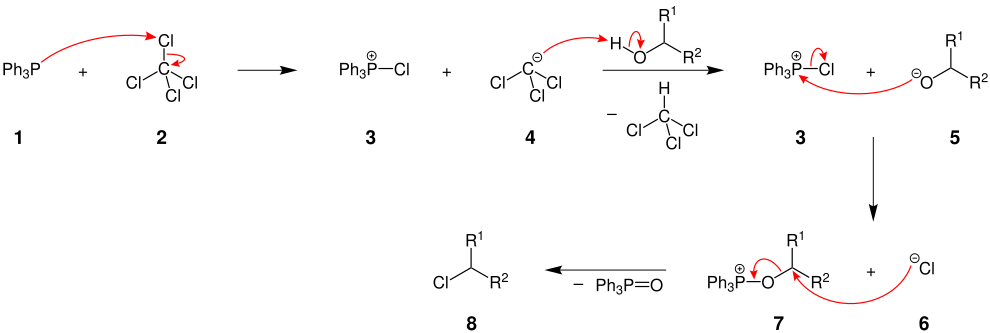
Der Mechanismus der Appel-Reaktion wird hier am Beispiel der Umsetzung von Triphenylphosphan, Tetrachlormethan und einem sekundären Alkohol beschrieben. Die Reste R1 und R2 sind dabei organische Reste:
Das Triphenylphosphan (1) wird durch das Tetrachlormethan (2) aktiviert und es bildet sich das Chlortriphenylphosphin (3) und ein deprotoniertes Chloroform (4). Das deprotonierte Chloroform (4) greift den Alkohol an, wodurch ein Alkoholat 5 entsteht. Dann erfolgt die Reaktion zwischen dem Triphenylphosphin (3) und dem Alkoholat 5. Das Molekül 7 wird gebildet und ein Chlorid-Ion aus dem Chlortriphenylphosphin (3) abgespalten. Im letzten Schritt wird Triphenylphosphinoxid als sehr gute Abgangsgruppe durch den nukleophilen Angriff des Chlorid-Ions 6 verdrängt und das gewünschte Produkt gebildet, in diesem Fall ein Chloralkan 8. Die Triebkraft der Reaktion ist die Bildung der O=P-Doppelbindung (Oxophilie des Phosphors), also die Oxidation von P(III) zu P(V).[2][3]
Die Appel-Reaktion ist eine milde und moderne Variante zur Chlorierung oder Bromierung unter SN2-Bedingungen. Sie ist daher stereoselektiv unter Inversion der Konfiguration.[4]
Praktische Bedeutung
Die Appel-Reaktion ist ein reines Laborverfahren. Wegen der Bildung stöchiometrischer Mengen Triphenylphosphinoxid und anderer Abfallstoffe ist die Atomökonomie der Appel-Reaktion so schlecht, dass niemand eine technische Synthese für ein Halogenalkan basierend auf dieser Reaktion realisiert.
Einzelnachweise
- ↑ Reinhard Brückner: Reaktionsmechanismen: Organische Reaktionen, Stereochemie, Moderne Synthesemethoden. 3. Auflage. Springer, 2004, ISBN 3-662-45683-4, S. 99.
- ↑ a b Appel-Reaktion. Abgerufen am 9. August 2019.
- ↑ Z. Wang: Comprehensive Organic Name Reactions and Reagents, 3 Volume Set, dort in Band 1, John Wiley & Sons, Hoboken, New Jersey 2009, ISBN 978-0-471-70450-8, S. 95.
- ↑ Substitutionsreaktionen an Aliphaten. EPF Lausanne, abgerufen am 2. November 2011.
Literatur
- Rolf Appel: Tertiary Phosphane/Tetrachloromethane, a Versatile Reagent for Chlorination, Dehydration, and P–N Linkage. In: Angewandte Chemie International Edition in English. 14, Nr. 12, 1975, S. 801–811, doi:10.1002/anie.197508011.
Weblinks
Auf dieser Seite verwendete Medien
Autor/Urheber: Whoopie23, Lizenz: CC BY-SA 3.0
Übersichtsreaktion der Appel-Reaktion
Autor/Urheber: Whoopie23, Lizenz: CC BY-SA 3.0
Mechanismus der Appel-Reaktion