Apixaban
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
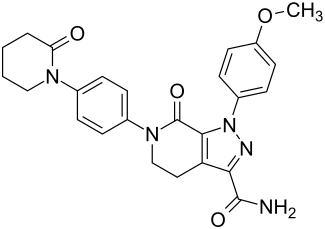 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Apixaban | |||||||||||||||||||||
| Andere Namen | 1-(4-Methoxyphenyl)-7-oxo-6-[4-(2-oxopiperidin-1-yl)phenyl]-4,5,6,7-tetrahydro-1H-pyrazolo[3,4-c]pyridin-3-carbamid (IUPAC) | |||||||||||||||||||||
| Summenformel | C25H25N5O4 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | B01AF02 | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 459,50 g·mol−1 | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Apixaban ist ein Arzneistoff aus der Gruppe der Antikoagulanzien. Es hemmt die Thrombokinase (auch Faktor Xa) und damit die Blutgerinnung, weshalb Apixaban und die ähnlichen Arzneistoffe Betrixaban, Edoxaban und Rivaroxaban auch als direkte Faktor-Xa-Hemmer (Xabane) bezeichnet werden. Die Substanz wurde in einer Kooperation zwischen den Firmen Pfizer und Bristol-Myers Squibb entwickelt.[2] Apixaban ist (etwa als Filmtablette à 2,5 mg) oral wirksam und wurde 2011 EU-weit unter dem Namen Eliquis zur Prophylaxe von venösen Thromboembolien (VTE) nach elektiven (planbaren, nicht notfallmäßigen) orthopädischen Operationen zugelassen; in Deutschland und der Schweiz: nach Hüft- und Knieersatzoperationen (Endoprothesen) bei Erwachsenen. Seit 20. Dezember 2012 ist Apixaban in der Europäischen Union auch zur Prävention von ischämischen Schlaganfällen (Hirninfarkt) und systemischen Embolien bei Erwachsenen mit nicht-valvulärem Vorhofflimmern zugelassen.[3] Im Juli 2014 erhielt Apixaban in der EU zusätzlich die Zulassung zur Therapie und Rezidivprophylaxe bei Lungenembolien und Tiefen Venenthrombosen (TVT).[4] Apixaban kann zukünftig auch zur Behandlung von VTE und zur Vorbeugung wiederkehrender VTE bei pädiatrischen Patienten im Alter von 28 Tagen bis unter 18 Jahren angewendet werden. Dafür werden neue Darreichungsformen und neue Stärken eingeführt (0,15 mg Granulat in Kapseln zum Öffnen sowie 0,5, 1,5 und 2 mg überzogenes Granulat in Beuteln).[5]
Pharmakologie
Apixaban ist ein direkter, selektiver Hemmer des an der Blutgerinnung beteiligten Enzyms Faktor Xa. Es wird oral verabreicht.
Apixaban wird im Gastrointestinaltrakt gut resorbiert. Die Bioverfügbarkeit liegt bei 50 %.[6] In der Leber wird die Substanz zu einem Phenolderivat oxidiert, wobei der Metabolismus über Cytochrom P450 eine untergeordnete Rolle spielt. Seine maximale Plasmakonzentration erreicht Apixaban nach drei bis vier Stunden.[7] Die Elimination erfolgt zu 75 % biliär und zu 25 % renal. Apixaban besitzt eine Halbwertszeit von etwa 9 bis 14 Stunden.
Apixaban ist kontraindiziert bei Patienten mit Hämophilie. Das Interaktionspotential mit anderen Arzneimitteln wird als gering eingeschätzt. Andexanet Alfa ist ein rekombinanter Hemmer von Apixaban.
Risikofaktoren für das Auftreten von Blutungen
Im September 2013 wiesen die Hersteller der neuen oralen Antikoagulanzien Apixaban, Dabigatranetexilat und Rivaroxaban in einem gemeinsamen, mit den zuständigen Arzneimittelbehörden abgestimmten Informationsbrief darauf hin, dass Meldungen unerwünschter Arzneimittelwirkungen (UAW) aus klinischen Studien und aus der Praxis gezeigt haben, dass auch bei den neuen oralen Antikoagulanzien ein signifikantes Risiko für schwere Blutungsereignisse, auch mit Todesfolge, besteht. Um das Blutungsrisiko zu minimieren, müssen die verordnenden Ärzte das Blutungsrisiko der Patienten individuell beurteilen und die Angaben zu Dosierung und Gegenanzeigen sowie Warnhinweise und gebotene Vorsichtsmaßnahmen beachten. Gemeinsam sind allen neuen oralen Antikoagulanzien die folgenden Gegenanzeigen:
- akute, klinisch relevante Blutungen
- Läsionen oder klinische Situationen, die als signifikanter Risikofaktor einer schweren Blutung angesehen werden
- gleichzeitige Anwendung von anderen Antikoagulanzien wie zum Beispiel Heparinen oder Vitamin-K-Antagonisten (mit wenigen Ausnahmen).
Auch eine Nierenfunktionsstörung kann eine Gegenanzeige darstellen, allerdings gelten hierbei für die drei Arzneimittel unterschiedliche Empfehlungen.[8]
Bewertung
Bei nicht valvulärem Vorhofflimmern und hohem Schlaganfallrisiko kann Apixaban in bestimmten Situationen eine Alternative zu Vitamin-K-Antagonisten wie Phenprocoumon sein. Dazu gehören schwierige INR-Einstellung unter Vitamin-K-Antagonisten, hohes Risiko für hämorrhagische Insulte oder intrazerebrale Blutungen sowie Unverträglichkeit, Kontraindikationen oder Interaktionen von Vitamin-K-Antagonisten mit zwingend erforderlichen anderen Arzneimitteln. Vorsicht ist geboten bei Patienten mit hohem Blutungsrisiko, vor allem solange für Apixaban kein spezifisches Antidot zur Verfügung stand, das bei schweren Blutungen oder vor dringlichen Operationen die Wirkung von Apixaban gezielt aufheben kann.[9]
Im Mai 2018 hat die US-Zulassungsbehörde FDA das rekombinante Protein Andexanet alfa als Antidot zugelassen. Im März 2019 hat die Europäische Zulassungsbehörde EMA die Zulassung (Handelsname in der EU: Ondexxya) für die EU empfohlen.[10] Im April 2019 kam es zu einer Zulassung durch die Europäische Kommission für die europäischen Mitgliedstaaten.[11][12][13][14]
Andexanet alfa ähnelt strukturell dem Faktor Xa, ist aber enzymatisch inaktiv. Es bindet Apixaban und wirkt somit der Bindung von Apixaban an den natürlich vorkommenden Faktor Xa entgegen.[15][16]
Frühe Nutzenbewertung
Seit 2011 müssen sich neu zugelassene Medikamente mit neuen Wirkstoffen aufgrund § 35a SGB V (AMNOG) einer frühen Nutzenbewertung durch den Gemeinsamen Bundesausschuss (G-BA) unterziehen, wenn der pharmazeutische Hersteller einen höheren Verkaufspreis als nur den Festbetrag erzielen möchte. Nur wenn ein Zusatznutzen besteht, kann der Arzneimittelhersteller mit dem Spitzenverband der gesetzlichen Krankenkassen einen Preis aushandeln. Dies galt auch für Apixaban. Im regulären Verfahrensablauf hat zunächst das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) eine Bewertung abgegeben. Es sah einen Zusatznutzen von Apixaban bei Hüftgelenkersatz, wohingegen sich bei Kniegelenksersatzoperationen kein Beleg für einen Zusatznutzen ergab.[17] Eine dieser Bewertung folgende Beschlussfassung (Hinweis für einen geringen Zusatznutzen von Apixaban bei Patienten mit elektiver Hüftgelenksersatzoperation) durch den G-BA erfolgte im Juni 2012.[18]
2012 kam als neues Anwendungsgebiet für Apixaban die Prophylaxe von Schlaganfällen und systemischen Embolien bei erwachsenen Patienten mit nicht-valvulärem Vorhofflimmern (NVAF) und einem oder mehreren Risikofaktoren hinzu, etwa Schlaganfall oder transitorische ischämische Attacke in der Anamnese, ein Alter von mindestens 75 Jahren, Hypertonie, Diabetes mellitus oder symptomatische Herzinsuffizienz (NYHA Klasse ≥II). Das IQWiG bewertete den Zusatznutzen gegenüber Vitamin-K-Antagonisten als zweckmäßiger Vergleichstherapie.[19] Gemäß G-BA-Beschluss gibt es für diese Indikation einen Hinweis auf einen geringen Zusatznutzen.[20]
2014 schließlich wurde Apixaban auch zur Behandlung von tiefen Venenthrombosen (TVT) und Lungenembolien (LE) sowie Prophylaxe von rezidivierenden TVT und LE bei Erwachsenen zugelassen. Für die Initial-Behandlung und die parallel einzuleitende Prophylaxe über einen Zeitraum von bis zu sechs Monaten wurde der Wirkstoff mit dem niedermolekularen Heparin Enoxaparin sowie dem Vitamin-K-Antagonisten Warfarin verglichen. Für die Langzeitprophylaxe von rezidivierenden TVT bzw. einer LE nach Abschluss einer sechsmonatigen Initial-Behandlung, nach der eine weiterführende Antikoagulation angezeigt ist, war Warfarin die zweckmäßige Vergleichstherapie,[21] Während der G-BA für die Initial-Behandlung einen Hinweis auf einen geringen Zusatznutzen sah, ist der Zusatznutzen einer Langzeitprophylaxe nicht belegt.[22]
Klinische Prüfung
In mehreren Studien wurden und werden die Einsatzmöglichkeiten des Arzneistoffs geprüft. Mögliche Indikationen sind die Thromboseprophylaxe nach orthopädischen Operationen, die Prophylaxe von ischämischen Hirninfarkten bei Vorhofflimmern, die Prophylaxe des akuten Koronarsyndroms und die Prophylaxe nach Thrombosen und Lungenembolien.
Folgende Studien laufen oder sind bereits abgeschlossen:
- Abgeschlossene Studien:
- ADVANCE-1-3 (Apixaban Dose Orally versus Anticoagulation with Enoxaparin, Phase-III-Studien): In der ADVANCE-1-Studie[23] wurde die Thromboseprophylaxe mit Apixaban 2 × 2,5 mg/Tag mit Enoxaparin 2 × 30 mg/Tag (US-amerikanisches Dosierungsregime) bei Patienten nach Implantation einer Kniegelenksprothese verglichen. Therapiebeginn war etwa 12 Stunden nach der Operation. Ziel der Studie war eine Nicht-Unterlegenheit von Apixaban nachzuweisen. Dies gelang nicht. Ein Ergebnis der Studie war, dass unter der Therapie mit Apixaban signifikant weniger Blutungskomplikationen aufgetreten sind. In der ADVANCE-2-Studie[24] wurde ebenfalls die Wirksamkeit der Thromboseprophylaxe nach Implantation einer Kniegelenksprothese untersucht. Therapiebeginn mit Apixaban war 12–24 Stunden nach Beendigung der Operation, mit Enoxaparin 12 Stunden vor der Operation. Es wurde eine Überlegenheit von Apixaban (2 × 2,5 mg/Tag) gegenüber der Therapie mit Enoxaparin (1× 40 mg/d) nachgewiesen. Ein ähnliches Studienergebnis wurde in der ADVANCE-3-Studie[25] gezeigt. Hier wurde die Thromboseprophylaxe bei Patienten mit Hüftgelenksersatz verglichen. Therapiebeginn und Dosis wurden wie bei der ADVANCE-2-Studie appliziert. Blutungskomplikationen sind unter der Therapie mit Apixaban nicht häufiger aufgetreten.[26]
- APPRAISE-2:[27] In dieser Studie wurde bei Patienten mit akutem Koronarsyndrom die Therapie mit Apixaban (2 × 5 mg p.o./Tag) im Vergleich zu einer Placebo-Therapie zusätzlich zur Monotherapie mit Acetylsalicylsäure oder zur dualen Plättchenhemmung mit Acetylsalicylsäure und Clopidogrel verglichen. Aufgrund einer signifikanten Zunahme des Blutungsrisikos unter Therapie mit Apixaban wurde die Studie vorzeitig beendet.[6]
- AVERROES[28] (Apixaban Versus ASA to Reduce the Rate of Embolic Stroke, Phase-III-Studie): In dieser Studie wurde die Therapie mit Apixaban (2 × 2,5 – 5 mg p.o./Tag) mit Acetylsalicylsäure (1 × 81–324 mg p.o./Tag) bei Patienten mit Vorhofflimmern verglichen, bei denen eine Therapie mit Vitamin-K-Antagonisten aus unterschiedlichen Gründen nicht durchgeführt wurde. Es wurde eine signifikante Überlegenheit von Apixaban in der Prävention von ischämischen Schlaganfällen und anderen systemischen Embolien bei gleichzeitig nicht signifikanter Zunahme von Blutungskomplikationen nachgewiesen, so dass die Studie vorzeitig abgebrochen wurde.[26]
- ARISTOTLE[29] (Apixaban for the Prevention of Stroke in Subjects With Atrial Fibrillation, Phase-III-Studie). Bei Patienten mit Vorhofflimmern wurde in dieser doppelblinden randomisierten Studie eine Nichtunterlegenheit der Therapie mit Apixaban (2 × 5 mg p.o./Tag) im Vergleich zu Warfarin (Ziel-INR: 2,0–3,0) nachgewiesen. Der Endpunkt der Studie war das Auftreten eines ischämischen oder hämorrhagischen Schlaganfalls oder einer systemischen Embolie. Nach einer medianen Nachbeobachtung von 1,8 Jahren wurde dieser Endpunkt mit einer Häufigkeit von 1,27 %/Jahr in der Apixaban-Gruppe und mit 1,60 %/Jahr in der Warfarin-Gruppe beobachtet (Reduktion des relativen Risikos um −21 %). Damit konnte die Nichtunterlegenheit von Apixaban gegenüber dem Warfarin statistisch signifikant bewiesen werden. Im Wesentlichen wurde die Rate an hämorrhagischen Schlaganfällen reduziert, nicht jedoch die Rate an ischämischen Schlaganfällen. Die absolute Häufigkeit von allen Blutungskomplikationen wurde um 7,7 % reduziert, die klinisch relevanten schweren Blutungen traten unter Apixaban um relativ 31 % seltener auf (2,13 %/Jahr vs. 3,09 %/Jahr).
- AMPLIFY: In dieser Phase-III-Studie wurde bei 5395 Patienten mit akuter tiefer Beinvenenthrombose und/oder akuter Lungenembolie die Therapie mit Apixaban (2 × 10 mg/Tag für 7 Tage, gefolgt von 2 × 5 mg/Tag für 6 Monate) im Vergleich zur Standardtherapie mit Enoxaparin gefolgt von Warfarin (Bridging-Therapie) verglichen. Das Ergebnis der Studie ist eine Nichtunterlegenheit von Apixaban im Vergleich zur konventionellen Therapie. Es traten signifikant weniger Blutungen auf.[30]
Gegenanzeigen
Bei rückenmarksnahen Regionalanästhesie-Verfahren (Spinalanästhesie bzw. Periduralanästhesie) sollte Apixaban 26–30 Stunden vorher abgesetzt werden und frühestens vier bis sechs Stunden nach dem Eingriff wieder gegeben werden.[31] Vor geplanten Operationen sollte Apixaban bei Eingriffen mit geringem Blutungsrisiko mindestens 24 Stunden abgesetzt werden. Bei Eingriffen, bei denen ein hohes Blutungsrisiko nicht ausgeschlossen werden kann oder inakzeptabel ist, beträgt die Zeit mindestens 48 Stunden, was mindestens vier Halbwertszeiten beim Nierengesunden entspricht. Bei Niereninsuffizienz kann diese Zeit deutlich verlängert sein.[32]
Literatur
- Weitz. In: Thromb Haemost, 2006, 96, S. 274–284
- Jennifer Carreiro, Jack Ansell: Apixaban, an oral direct Factor Xa inhibitor: awaiting the verdict. In: Expert Opin. Investig. Drugs, 2008, 17(12), S. 1937–1945
Weblinks
- Einträge. In: NIH-Studienregister.
- Öffentlicher Beurteilungsbericht (EPAR) der Europäischen Arzneimittel-Agentur (EMA) zu: Apixaban
Einzelnachweise
- ↑ a b Datenblatt Apixaban bei Sigma-Aldrich, abgerufen am 3. Januar 2023 (PDF).
- ↑ Lisa Nainggolan: Apixaban better than European enoxaparin regimen for preventing VTE. Abgerufen am 3. Oktober 2011.
- ↑ Neue Arzneimittel (PDF; 150 kB). Information der Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ), Stand 5. März 2013, letzter Abruf am 17. September 2013.
- ↑ European Commission Approves Eliquis (apixaban) for the Treatment of Deep Vein Thrombosis (DVT) and Pulmonary Embolism (PE), and Prevention of Recurrent DVT and PE ( vom 9. Februar 2019 im Internet Archive). Pressemitteilung der Herstellerfirma Bristol-Myers Squibb. Abgerufen am 16. September 2014.
- ↑ Eliquis - opinion on variation to marketing authorisation, EMA vom 30. Mai 2024, abgerufen am 6. August 2024
- ↑ a b D. Garcia, E. Libby, M. A. Crowther: The new oral anticoagulants. In: Blood, Band 115, Nummer 1, Januar 2010, S. 15–20, doi:10.1182/blood-2009-09-241851, PMID 19880491. (Review).
- ↑ Jörg Braun: Blut, Blutprodukte und Gerinnungsstörungen. In: Jörg Braun, Roland Preuss (Hrsg.): Klinikleitfaden Intensivmedizin. 9. Auflage. Elsevier, München 2016, ISBN 978-3-437-23763-8, S. 539–579, hier: S. 562 (Apixaban).
- ↑ Informationsbrief zu Risikofaktoren für das Auftreten von Blutungen vom 05. September 2013. (PDF; 2,5 MB) Abgerufen am 9. September 2013.
- ↑ Neue Arzneimittel (PDF; 150 kB) Information der Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ), Stand: 5. März 2013.
- ↑ Das erste Antidot für Apixaban und Rivaroxaban kommt nach Europa. Deutsche Apotheker Zeitung online, 4. März 2019, abgerufen am 9. August 2019.
- ↑ Übersicht über Ondexxya und warum es in der EU zugelassen ist (PDF; 120 kB) EMA April 2019, abgerufen am 9. August 2019
- ↑ Ondexxya - andexanet alfa. EMA (englisch) abgerufen am 9. August 2019
- ↑ European Commission Grants Conditional Marketing Authorization for Portola Pharmaceuticals’ Ondexxya™ (andexanet alfa), the First and Only Antidote for the Reversal of Factor Xa Inhibitors ( vom 27. April 2019 im Internet Archive), PM Portola vom 26. April 2019, abgerufen am 29. April 2019
- ↑ Beschleunigte Zulassung für Antidot. In: Pharmazeutische Zeitung, 1. März 2019; abgerufen am 9. August 2019
- ↑ thepharmaletter.com Abgerufen am 17. Mai 2018.
- ↑ aerzteblatt.de Abgerufen am 17. Mai 2018.
- ↑ A11-30 Apixaban - Nutzenbewertung gemäß § 35a SGB V (Dossierbewertung). iqwig.de; abgerufen am 23. März 2020.
- ↑ Nutzenbewertungsverfahren zum Wirkstoff Apixaban (Prophylaxe venöser Thromboembolien). g-ba.de; abgerufen am 23. März 2020.
- ↑ A12-20 Apixaban - Nutzenbewertung gemäß § 35a SGB V (Dossierbewertung). iqwig.de; abgerufen am 23. März 2020.
- ↑ Nutzenbewertungsverfahren zum Wirkstoff Apixaban (neues Anwendungsgebiet: Prophylaxe von Schlaganfällen und systemischen Embolien). g-ba.de; abgerufen am 23. März 2020.
- ↑ A14-28 Apixaban (Zulassungsweiterung) - Nutzenbewertung gemäß § 35a SGB V (Dossierbewertung). iqwig.de; abgerufen am 23. März 2020.
- ↑ Nutzenbewertungsverfahren zum Wirkstoff Apixaban (neues Anwendungsgebiet: Behandlung und Prophylaxe von Venenthrombosen und Lungenembolien). g-ba.de; abgerufen am 23. März 2020.
- ↑ M. R. Lassen, G. E. Raskob, A. Gallus, G. Pineo, D. Chen, R. J. Portman: Apixaban or enoxaparin for thromboprophylaxis after knee replacement. In: The New England journal of medicine Band 361, Nummer 6, August 2009, S. 594–604, doi:10.1056/NEJMoa0810773. PMID 19657123.
- ↑ M. R. Lassen, G. E. Raskob, A. Gallus, G. Pineo, D. Chen, P. Hornick: Apixaban versus enoxaparin for thromboprophylaxis after knee replacement (ADVANCE-2): a randomised double-blind trial. In: The Lancet Band 375, Nummer 9717, März 2010, S. 807–815, doi:10.1016/S0140-6736(09)62125-5, PMID 20206776.
- ↑ M. R. Lassen, A. Gallus, G. E. Raskob, G. Pineo, D. Chen, L. M. Ramirez: Apixaban versus enoxaparin for thromboprophylaxis after hip replacement. In: The New England journal of medicine Band 363, Nummer 26, Dezember 2010, S. 2487–2498, doi:10.1056/NEJMoa1006885, PMID 21175312.
- ↑ a b J. Ansell: Warfarin versus new agents: interpreting the data. In: Hematology / the Education Program of the American Society of Hematology. American Society of Hematology. Education Program Band 2010, 2010, S. 221–228, doi:10.1182/asheducation-2010.1.221, PMID 21239798.
- ↑ APPRAISE Steering Committee and Investigators, JH Alexander, RC Becker, DL Bhatt et al.: Apixaban, an oral, direct, selective factor Xa inhibitor, in combination with antiplatelet therapy after acute coronary syndrome: results of the Apixaban for Prevention of Acute Ischemic and Safety Events (APPRAISE) trial. Circulation 2009;119:2877–2885, doi:10.1161/CIRCULATIONAHA.108.832139, PMID 19470889.
- ↑ S. J. Connolly, J. Eikelboom u. a.: Apixaban in patients with atrial fibrillation. In: The New England journal of medicine, Band 364, Nummer 9, März 2011, S. 806–817, doi:10.1056/NEJMoa1007432, PMID 21309657.
- ↑ CB Granger, JH Alexander, JJV McMurray et al. for the ARISTOTLE Committees and Investigators: Apixaban versus Warfarin in Patients with Atrial Fibrillation. In: N Engl J Med, 2011, 365(11), S. 981–992, PMID 21870978.
- ↑ G. Agnelli, H. R. Buller u. a.: Oral apixaban for the treatment of acute venous thromboembolism. In: The New England Journal of Medicine, Band 369, Nummer 9, August 2013, S. 799–808, doi:10.1056/NEJMoa1302507, PMID 23808982.
- ↑ Wiebke Gogarten, Hugo Van Aken: Perioperative Thromboseprophylaxe – Thrombozytenaggregationshemmer – Bedeutung für die Anästhesie In: AINS – Anästhesiologie · Intensivmedizin · Notfallmedizin · Schmerztherapie, 47, 2012, S. 242–252, doi:10.1055/s-0032-1310414.
- ↑ Fachinformation Eliquis.
Auf dieser Seite verwendete Medien
Structure of 1-(4-methoxyphenyl)-7-oxo-6-(4-(2-oxopiperidin-1-yl)phenyl)-4,5,6,7-tetrahydro-1H-pyrazolo[3,4-c]pyridine-3-carboxamide
