Aortenisthmusstenose
| Klassifikation nach ICD-10 | |
|---|---|
| Q25.1 | Koarktation der Aorta Aortenisthmusstenose |
| ICD-10 online (WHO-Version 2019) | |
Unter einer Aortenisthmusstenose, Isthmusstenose der Aorta (ISTA) oder Koarktation der Aorta (Coarctatio aortae), kurz auch Isthmusstenose genannt, versteht man die Einengung (Stenose) der Aorta (Körperhauptschlagader) im Bereich des Aortenbogens. Sie ist eine Gefäßfehlbildung, die alleinstehend, aber auch in Verbindung mit angeborenen Herzfehlern vorkommt. Sie macht etwa sechs bis acht Prozent aller angeborenen Herzfehler aus, ist bei Männern häufiger als bei Frauen und tritt häufig beim Vorliegen des Turner-Syndroms (Monosomie X) auf.

Entstehung
Zur Entstehung des erstmals 1760 von Morgagni beschriebenen Krankheitsbildes[1] gibt es zwei Theorien:
- ein verminderter Blutfluss während der Embryonalzeit in der aufsteigenden Aorta oder
- versprengtes Gewebe des Ductus arteriosus, der sich bald nach der Geburt aktiv und stark zusammenzieht.
Formen
Traditionell werden nach Lokalisation der Stenose in Bezug auf den Ductus arteriosus (Ductus Botalli) die präduktale und die postduktale Aortenisthmusstenose unterschieden. Diese Einteilung ist heute zwar zum Teil verlassen, da die beiden Formen während der Embryonalperiode ineinander übergehen können; aufgrund von Unterschieden in Beschwerdensymptomatik und Prognose wird sie hier aber dennoch wiedergegeben.
Der Ductus arteriosus leitet vor der Geburt das vom rechten Herzen her kommende Blut fast vollständig an den Lungenarterien vorbei, in die Aorta um. Es besteht also ein Kurzschluss zwischen Lungen- und Körperkreislauf, bei dem der Körperkreislauf große Mengen Blutes aus dem Lungenkreislauf erhält. Die Lungen sind in dieser Zeit noch nicht in Funktion, es wäre daher unsinnig, ihnen eine privilegierte Blutversorgung zukommen zu lassen. Mit der Geburt verschließt sich der Ductus arteriosus normalerweise – die beiden Kreisläufe sind von nun an getrennt. In der Lunge findet die Anreicherung des Blutes mit Sauerstoff statt, während das linke Herz es in den gesamten Körper treibt.
Präduktale ISTA
auch: infantile Form der ISTA
Liegt die Verengung der Aorta vor der Einmündung des Ductus arteriosus Botalli, so hat das linke Herz zunächst gegen einen erhöhten Flusswiderstand aufgrund der verengten Schlagader anzukämpfen. Bei schwerer Verengung kommt das linke Herz gegen diese Belastung bald nicht mehr an (Linksherzinsuffizienz), das Blut staut sich darüber hinaus zurück bis in die Lungen, aus denen es nicht mehr „abgepumpt“ werden kann – die Folge ist Luftnot (Dyspnoe).
Der Ductus arteriosus selbst bleibt in solchen Fällen nach der Geburt häufig offen und mündet nach der Stenose in die Aorta ein. Dies führt zu einer Beimischung venösen Blutes in die Aorta und damit die gesamte untere Körperhälfte. Diese erscheint zyanotisch (bläulich verfärbt), es kann zu prärenalem Nierenversagen durch verminderte und sauerstoffarme Nierendurchblutung kommen. Ein Pulsdefizit zwischen oberer und unterer Körperhälfte, das ansonsten typisch für die ISTA ist, kann in diesen Fällen fehlen – schließlich erhält die Aorta über den Ductus arteriosus Blut aus dem rechten Herzen.
Die präduktale Form der ISTA wird normalerweise bald nach der Geburt symptomatisch und führt zu akuter Lebensgefahr für das Neugeborene (s. u.). Daher auch die Benennung „infantile Form“. Die Unterteilung in einen infantilen Typ und einen Erwachsenentyp wurde 1903 von dem französischen Arzt D. Bonnet[2] vorgenommen.
Postduktale ISTA
auch: adulte Form der ISTA

Befindet sich die Stenose nach dem Abgang des Ductus arteriosus, so kann das Blut in der Regel Ausweichbahnen (Kollateralen) über die inneren Brust- und die Zwischenrippenarterien nutzen (Aa. thoracicae internae und intercostales). Diese sind daher erweitert und zeigen sich im Röntgenbild als Rippenusuren.
Es besteht in diesem Fall zwar ein erhöhter Blutdruck in der oberen Körperhälfte, dieser ist jedoch nicht derart hoch wie bei der präduktalen Form und überlastet das linke Herz zunächst nicht. Auch ist der Ductus arteriosus in diesem Fall in der Regel verschlossen, es kommt also nicht zur Beimischung sauerstoffarmen Blutes in den Körperkreislauf.
Bei dieser Form findet sich typischerweise das erwähnte Defizit zwischen Arm- und Beinpulsen: An den Armen besteht ein hoher (erhöhter) Blutdruck mit deutlich tastbaren Pulsen, an den Beinen dagegen ein relativ niedriger Blutdruck mit schwachen oder gar nicht auffindbaren Pulsen.
Die postduktale Form der ISTA bleibt häufig jahrelang symptomlos und zeigt sich erst im Schulkindes- bzw. Jugend- oder frühen Erwachsenenalter. Daher auch die Benennung „adulte Form“.
Ausprägung
- sanduhrförmig (kurz und an einer Stelle sehr eng)
- tunnelförmig (längere Einengung mit deutlich weiteren Aortenanteilen davor und danach)
- längerstreckig mit geringer Unterentwicklung des Aortenbogens
- ausgeprägte Unterentwicklung des gesamten Aortenbogens
Auswirkungen
Ein Neugeborenes kann durch eine (insbesondere präduktale) Aortenisthmusstenose im Laufe der Kreislaufumstellung in den ersten Lebenstagen oder -wochen in eine krisenhafte Situation geraten. Die untere Körperhälfte mit allen inneren Organen (Niere, Leber, Darm) ist durch die Verengung der Aorta schlecht mit arteriellem Blut versorgt. Infolge der unzureichenden Leberdurchblutung liegt nicht selten eine übermäßige Neugeborenengelbsucht (Hyperbilirubinämie) vor. Durch die zunehmende Herzbelastung entsteht rasch eine kardiale Schocksymptomatik mit blass-grau-fahlem Aussehen der Neugeborenen. Beim fortgeschrittenen Schock liegt ein Nierenversagen mit fehlender Urinausscheidung vor – dies wird auf Nachfrage von den Eltern oft im Nachhinein bestätigt. Da alle diese Symptome auch im Rahmen einer schweren Neugeboreneninfektion auftreten können, wird oft unter diesem Verdacht zunächst mit Antibiotika behandelt und es vergeht manchmal wertvolle Zeit bis zur korrekten Diagnosestellung durch eine Echokardiographie und dem Beginn der lebensrettenden Prostaglandingabe. In dieser Zeit kann sich eine schockbedingte Übersäuerung des Blutes ausbilden (metabolische Azidose; arterieller pH nicht selten unter 7,0!), die dann meist eine bleibende Hirnschädigung hinterlässt. Jeder Arzt, der Neugeborene behandelt, muss dieses Krankheitsbild kennen und bei verdächtigen Symptomen lieber einmal zu viel als zu spät einen Kinderkardiologen zu Hilfe ziehen.
Es kommt aber (besonders bei der postduktalen Form) auch gar nicht so selten vor, dass eine ISTA erst bei größeren Kindern oder im Jugendlichen- oder Erwachsenenalter diagnostiziert wird. Bei diesen Patienten finden sich als Folge der Engstelle zahlreiche Umgehungs- bzw. Kollateralkreisläufe. Besonders die Gefäße der Rippen, im Schulterbereich und die Brustwandarterien können sich enorm vergrößert haben.[3]
Diagnostik
- Pränatal (vorgeburtlich) fällt bei betroffenen Kindern nicht selten eine ausgeprägte Nackentransparenz auf; die ISTA selbst ist jedoch unter Umständen schwer erkennbar, da sie sich erst nach dem Verschluss des Ductus Botalli manifestiert.
- Der postnatale (nachgeburtliche) erste Hinweis auf eine ISTA sind die schwachen/fehlenden Femoralispulse (in der Leistenbeuge) bei der klinischen Untersuchung. Die untere Körperhälfte erscheint zyanotisch.
- Bei der Auskultation ist ein systolisches (in der Phonokardiographie spindelförmiges) Geräusch über der Herzbasis und zwischen den Schulterblättern zu hören.
- Das Elektrokardiogramm zeigt u. U. eine Linksherzbelastung.
- Das Pulsdefizit bzw. die Blutdruckdifferenz in den oberen und unteren Extremitäten sind, besonders beim größeren Kind, Jugendlichen oder Erwachsenen, sichere Krankheitszeichen. Vor der Engstelle ist der Blutdruck zu hoch, nach der Engstelle zu niedrig.
- Die Langzeitblutdruckmessung an Armen und Beinen mit Feststellung der absoluten Blutdruckspitzen und des Tag-Nacht-Rhythmus.
- Die Echokardiografie wird eingesetzt, ist aber u. U. beim Neugeborenen nicht beweisend, z. B. bei gleichzeitig bestehendem Atriumseptumdefekt oder Ventrikelseptumdefekt.
- Röntgenaufnahmen beim Neugeborenen zeigen meistens nur eine Herzvergrößerung mit Lungenstauung. Bei Jugendlichen und Erwachsenen Rippenusuren als Folge des Kollateralkreislaufes.
- Die Herzkatheteruntersuchung beim Neugeborenen ist zur Diagnostik einer alleinigen ISTA nur selten indiziert, jedoch wichtig wenn weitere Herzfehlbildungen vorliegen.
- Die Magnetresonanztomografie (=Kernspintomografie, MRT, NMR) ermöglicht eine gute Darstellung der ISTA. Durch die Flussmessungen ist eine Gradientenabschätzung möglich und gleichfalls eine 3-D-Rekonstruktion durchführbar.
- Mit der Spiral-Computertomografie ist gleichfalls eine 3-D-Rekonstruktion möglich.
Die beiden zuletzt genannten Untersuchungsmethoden dienen der anatomischen Rekonstruktion bei zusätzlich vorliegenden Aortenbogenfehlbildungen bzw. Variationen.
Therapie
Beide Formen der ISTA bedürfen der sorgfältigen Überwachung und Therapie – die präduktale ISTA zieht unbehandelt eine Letalität von 60–90 % bereits im Säuglingsalter nach sich. Hier ist die schnelle operative Korrektur angezeigt. Die postduktale Form führt bei entsprechend starker Ausprägung ebenso zu einer Einschränkung der Lebenserwartung – die operative Korrektur ist daher trotz des zunächst geringen Beschwerdebildes auch hier indiziert und sollte bis spätestens zum 6. Lebensjahr erfolgen. Immer vonnöten ist also eine sorgfältige Einschätzung und Planung des weiteren Vorgehens von qualifizierter Seite (Pädiater und Kinderchirurgen).
- Die Ballondilatation mit dem Herzkatheter und evtl. eine Stentimplantation, mit dem die Engstelle auf Dauer offen gehalten wird.
Die Ballondilatation ist die Methode der Wahl bei Re-Stenosen und bei älteren Kindern. - Die Operation (erstmals durch Clarence Crafoord[4] im Oktober 1944 bei einem 12-jährigen und einem 27-jährigen Patienten in Stockholm und 1945 durch Robert E. Gross erfolgt), bei der bei einer kurzstreckigen ISTA der verengte Teil herausgeschnitten wird und die Enden in Form einer End-zu-End-Anastomose verbunden werden.[5] Der Thoraxchirurg Karl Vossschulte erweiterte 1955 das klassische Crafoord’sche Vorgehen um ein gefäß-plastisches Verfahren,[6] die Isthmusplastik[7] zur Behandlung der Coarctatio aortae.[8] Bei einer längerstreckigen ISTA kommen verschiedene Operationsmethoden zur Anwendung, über die individuell entschieden werden muss. Die Operation kann ohne Einsatz der Herz-Lungen-Maschine durchgeführt werden, da die Herzfunktion nicht tangiert wird.
- Die medikamentöse Therapie mit blutdrucksenkenden Mitteln.
- Für Ungeborene, bei denen im Rahmen vorgeburtlicher Ultraschalluntersuchungen ihres Herzens (fetale Echokardiographie) die Entwicklung einer Aortenisthmusstenose vermutet wird, wurde am Deutschen Zentrum für Fetalchirurgie und minimal-invasive Therapie (DZFT) ein vorgeburtliches Behandlungsverfahren (materno-fetale Hyperoxygenierung) entwickelt. Hierbei atmet die Schwangere über eine Maske in drei Sitzungen jeweils drei bis vier Stunden täglich Sauerstoff in einer Konzentration von 45 % ein. Der Sauerstoff erreicht über den Mutterkuchen (Plazenta) das Ungeborene und führt zu einer Erweiterung seiner Lungengefäße. Der hierdurch erhöhte Lungenblutfluss erreicht durch das linke Herz auch den Aortenbogen. Die Behandlung wird ab der 34. Schwangerschaftswoche über etwa drei bis vier Wochen durchgeführt und führt bei Ungeborenen mit geeigneten Voraussetzungen zu einer deutlichen Größenzunahme des unterentwickelten Aortenbogens.[9] 2016 wurde zur materno-fetalen Hyperoxygenierung eine prospektive kontrollierte randomisierte Studie veröffentlicht[10], die die Wirksamkeit des Verfahrens am Beispiel von Ungeborenen belegt, bei denen nach ihrer Geburt eine behandlungsbedürftige Aortenisthmusstenose erwartet wurde: Ohne Sauerstofftherapie mussten 75 Prozent der untersuchten Feten nach ihrer Geburt an ihrer ISTA operiert werden, nach vorgeburtlicher Sauerstofftherapie nur 20 Prozent.
Langzeitaussichten
Die Patienten sind auf lebenslange Kontrolluntersuchungen angewiesen, insbesondere auf die Kontrolle und Behandlung eines Bluthochdrucks, der sich bei längerem Bestehen der ISTA möglicherweise gebildet hat.[3]
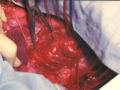
- Intraoperatives Bild mit einer präparierten Isthmusstenose mit aneurysmatisch veränderten Interkostalarterien
- Diagramm – Aortenisthmusstenose mit Engstelle (Stenose) zur Ausschneidung und End-to-End-Anastomose
- Aortenisthmusstenose – intraoperatives Bild nach Resektion der Engstelle
- Aortenisthmusstenose – End-to-End-Anastomose
- Aortenisthmusstenose – Rekonstruktion 3D
- Koarktation der Aorta mit verschiedenen bildgebenden Verfahren:
A – Enge Koarktation am Aortenisthmus (Pfeil)
B – Kontrastverstärktes 3D-CT-Angiogramm mit einem leicht verengten Bare-Metal-Stent (Pfeil), der teilweise den Ursprung der linken Arteria subclavia bedeckt. Die Pfeilspitze zeigt ein subtiles Pseudoaneurysma am distalenEnde des Stents.
C – Kontrastverstärktes 3D-Angiogramm mit Aortenbogenhypoplasie und Koarktation mit posteriorem Bypass-Transplantat (Pfeil)
D – MR 3D-kontrastverstärktes Angiogramm mit großem Pseudoaneurysma (Pfeilspitze) nach vorheriger plastischer Operation Angioplastie. Auf der Rückseite ist echtes Licht zu sehen (Pfeil)[11]
Literatur
- S2k-Leitlinie Aortenisthmusstenose der Deutschen Gesellschaft für Pädiatrische Kardiologie (DGPK). In: AWMF online (Stand 2013)
- Reinhard Larsen: Anästhesie und Intensivmedizin in Herz-, Thorax- und Gefäßchirurgie. (1. Auflage 1986) 5. Auflage. Springer, Berlin/Heidelberg/New York u. a. 1999, ISBN 3-540-65024-5, S. 334–338.
- Klaus Holldack, Klaus Gahl: Auskultation und Perkussion. Inspektion und Palpation. Thieme, Stuttgart 1955; 10., neubearbeitete Auflage ebenda 1986, ISBN 3-13-352410-0, S. 184–187 und 196 f.
Weblinks
- Vorgeburtliche Behandlung einer Aortenisthmusstenose im DZFT (bzw. unterbrochener Aortenbogen, Unterentwicklung des linken Herzens, Linksherzhypoplasie, Coarctation)
Einzelnachweise
- ↑ Friedrich Wilhelm Hehrlein: Herz und große Gefäße. In: Franz X. Sailer, F. W. Gierhake (Hrsg.): Chirurgie historisch gesehen: Anfang – Entwicklung – Differenzierung. Dustri-Verlag, Deisenhofen bei München 1973, ISBN 3-87185-021-7, S. 164–185, hier: S. 172.
- ↑ Friedrich Wilhelm Hehrlein: Herz und große Gefäße. In: Franz X. Sailer, F. W. Gierhake (Hrsg.): Chirurgie historisch gesehen: Anfang – Entwicklung – Differenzierung. Dustri-Verlag, Deisenhofen bei München 1973, ISBN 3-87185-021-7, S. 164–185, hier: S. 172.
- ↑ a b Wlodzimierz. Kuroczynski, Marc Hartert, Diethard Pruefer, Katrin Pitzer-Hartert, Markus Heinemann, Christian-Friedrich Vahl: Surgical treatment of aortic coarctation in adults: Beneficial effect on arterial hypertension. In: Cardiol. J. 8. Jahrgang, Nr. 6, 2008, S. 537–542, PMID 19039758.
- ↑ Vgl. Clarence Crafoord, G. Nylin: Congenital coarctation of aorta and its surgical treatment. In: Journal of Thoracic Surgery. Band 14, 1945, S. 347 ff.
- ↑ Clarence Crafoord, G. Nylin: Congenital coarctation of the aorta and its surgical treatement. In: J Thorac Surg. Band 14, 1945, S. 347–361.
- ↑ Rudolf Nissen: Zum Geleit. In: Franz Xaver Sailer, Friedrich Wilhelm Gierhake (Hrsg.): Chirurgie historisch gesehen. Anfang – Entwicklung – Differenzierung. Zum 65. Geburtstag von Prof. Dr. K. Vossschulte, Direktor der Chirurgischen Universitätsklinik und Poliklinik Gießen. Dustri-Verlag, Deisenhofen bei München 1973, ISBN 3-87185-021-7, S. XI–XIII, hier: S. XII.
- ↑ Karl Vossschulte: Isthmusplastik zur Behandlung der Aortenisthmusstenose. In: Thoraxchirurgie. Band 4, 1957, S. 443 ff.
- ↑ Friedrich Wilhelm Hehrlein: Herz und große Gefäße. In: Franz X. Sailer, F. W. Gierhake (Hrsg.): Chirurgie historisch gesehen: Anfang – Entwicklung – Differenzierung. Dustri-Verlag, Deisenhofen bei München 1973, ISBN 3-87185-021-7, S. 164–185, hier: S. 172 f.
- ↑ T. Kohl, K. Tchatcheva, R. Stressig, A. Geipel, S. Heitzer, U. Gembruch: Maternal hyperoxygenation in late gestation promotes rapid increase of cardiac dimensions in fetuses with hypoplastic left hearts with intrinsically normal or slightly abnormal aortic and mitral valves. In: Ultraschall in Med. 29, 2008, S. 92.
- ↑ Shi Zeng, Jiawei Zhou, Qinghai Peng, Wen Deng, Ming Zhang: Sustained maternal hyperoxygenation improves aortic arch dimensions in fetuses with coarctation. In: Scientific Reports. Band 6, Nr. 1, Dezember 2016, ISSN 2045-2322, doi:10.1038/srep39304 (nature.com [abgerufen am 13. Juli 2018]).
- ↑ N. Hopewell, Marina L. Hughes, Andrew M. Taylor: Die Rolle der kardiovaskulären Magnetresonanz bei angeborenen Herzerkrankungen bei Kindern. In: Journal of Cardiovascular Magnetic Resonance. Band 13, 2011, S. 51.
Auf dieser Seite verwendete Medien
Autor/Urheber: Kuroczynski, Lizenz: CC BY-SA 4.0
Intraoperatives Bild der Aortenisthmusstenose nach Resektion der Stenosestelle und vor End-to-End-Anastomose
Autor/Urheber: Kuroczynski, Lizenz: CC BY-SA 4.0
Coarctation of the aorta after end-to-end anastomosis
Autor/Urheber: Hopewell N Ntsinjana , Marina L Hughes and Andrew M Taylor, Lizenz: CC BY 2.0
Aortic coarctation. A. 'Black-blood' oblique sagittal view showing discrete, tight coarctation at the aortic isthmus (arrow). B. 3D, contrast-enhanced CT angiogram showing mildly narrowed bare metal stent (arrow) that partially overlies the left subclavian artery origin. The arrowhead shows a subtle pseudo-aneurysm at the distal end of the stent. C. 3D, contrast-enhanced MR angiogram showing aortic arch hypoplasia and coarctation with a 'jump' by-pass graft posteriorly (arrow). D. 3D, contrast-enhanced MR angiogram showing large pseudo-aneurysm (arrowhead) after previous patch angioplasty repair. The true lumen is shown posteriorly (arrow).
Autor/Urheber: Osmosis, Lizenz: CC BY-SA 4.0
What is coarctation of the aorta? An aortic coarctation is a narrowing of the aorta, which is split into infant and adult forms. In the infant form, it's often accompanied by patent ductus arteriosus, and mixing of deoxygenated and oxygenated blood, whereas in the adult form, the ductus arteriosus has closed off. This video covers the pathphysiology for both forms, as well as important complications and treatment options.
MRI picture of a coarctation of the aortic arch. Yellow arrow points at narrowing. Picture released with consent of my employer
MRI-picture of coarctatio aortae with collaterals. Picture released with consent of my employer
Autor/Urheber: Der ursprünglich hochladende Benutzer war Jccmoon in der Wikipedia auf Englisch, Lizenz: CC BY 3.0
coarctation of the aorta by CMR
Autor/Urheber: Kuroczynski, Lizenz: CC BY-SA 4.0
Koarktacja aorty