Antiretrovirale Therapie
Die antiretrovirale Therapie (ART) (auch hochaktive antiretrovirale Therapie, kurz HAART (englisch highly active antiretroviral therapy) oder auch antiretrovirale Kombinationstherapie, kurz cART (englisch combined antiretroviral therapy)) ist die medikamentöse Behandlung bei Menschen mit einer HIV-1-Infektion.
Das vorrangige Therapieziel ist die vollständige Suppression von HIV, so dass sich das Virus nicht mehr vermehren kann.[1] Infolgedessen soll die Krankheitsprogression verhindert, die Funktion des Immunsystems aufrechterhalten bzw. wiederhergestellt, infektionsbedingte Symptome unterdrückt und die Lebenserwartung sowie -qualität normalisiert werden. Außerdem verhindert sie auch die Übertragung von HIV zwischen serodiskordanten Personen, solange die HIV-positive Person eine nicht nachweisbare Viruslast aufrechterhält. Im Regelfall verhindert eine antiretrovirale Therapie auch die Übertragung einer HIV-Infektion von einer schwangeren Frau auf das ungeborene Kind.
Die ART ist eine Therapiestrategie, die eine lebenslange Einnahme ohne Unterbrechungen erfordert. Eine Abweichung kann das Risiko für Resistenzen erhöhen und damit ein Therapieversagen verursachen. Eine Heilung von HIV, also der vollständigen Eliminierung des replikationsfähigen Virus im Körper, kann durch sie aber nicht erreicht werden.
Indikation
Die unter Federführung der DAIG gemeinsam mit der ÖAG und weiterer medizinischer Fachgesellschaften erarbeitete Deutsch-Österreichische Leitlinien zur antiretroviralen Therapie der HIV-1-Infektion sieht den schnellstmöglichen – binnen weniger Tage und Wochen nach einem positiven HIV-Test – Therapiebeginn, unabhängig von Immunstatus und Plasmaviruslast, vor. Der Therapiebeginn soll nur in Ausnahmefällen verzögert werden. Die Ausnahmen bilden einerseits die akut behandlungsbedürftige opportunistische Infektionen Zerebrale Kryptokokkose und bestimmte Tuberkulose-Konstellationen. Andererseits können asymptomatische HIV-Infizierte Patienten ohne beeinträchtigten Immunstatus und sogenannte Elite Controller, also Personen deren HIV-Infektion asymptomatisch, chronisch, niedrig-virämisch ohne Entwicklung eines Immundefekts abläuft, eine antiretroviralen Therapie verzögert beginnen.[1]
Bis September 2020 empfahl die Deutsch-Österreichische Leitlinien zur antiretroviralen Therapie der HIV-Infektion der AWMF[2] ein abgestuftes Verfahren unter Abwägung des Einzelnutzens und der Risiken und Nebenwirkungen einer antiretroviralen Therapie vor. Die entsprechenden Risiken und Nebenwirkungen müssen aus heutiger Perspektive jedoch als so gering betrachtet werden, dass ein späterer Therapiebeginn regelhaft einen fortschreitenden Immundefekt verursacht und daher mit erhöhten Risiken für Infektionserkrankungen, Tumorerkrankungen, vorzeitige degenerative Erkrankungen und Organschäden sowie mit einer erhöhten Mortalität einhergeht.
Therapie
Wirkmechanismen

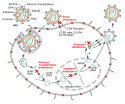
Für eine Antiretrovirale Therapie stehen verschiedene Wirkstoffklassen zur Verfügung, welche an unterschiedlichen Punkten der Pathogenese eingreifen. Mit Stand 2022 sind über 30 Präparate aus sechs verschiedenen Wirkstoffklassen zugelassen:[3]
- Nukleosidische bzw. Nukleotidische Reverse-Transkriptase-Inhibitoren (NRTIs)
- Nichtnukleosidische Reverse-Transkriptase-Inhibitoren (NNRTIs)
- Protease-Inhibitoren (PIs)
- Integrase-Strangtransfer-Inhibitoren (INSTIs)
- Entry-Inhibitoren:
- Kapsid-Inhibitoren
Nukleosidische Reverse-Transkriptase-Inhibitoren (NRTIs)
Nukleosidische Reverse-Transkriptase-Inhibitoren (NRTIs)[4] sind Nukleosidanaloga, die den natürlichen Nukleosiden ähneln. Sie werden von der Zelle unverändert aufgenommen, und zu Triphosphatderivate intrazellulär in ihre aktive Form umgewandelt. Ihr Ansatzpunkt ist die Reverse Transkriptase von Retroviren, die das virale RNA-Genom in DNA umschreibt. Sie konkurrieren mit natürlichen Nukleosiden, unterscheiden sich allerdings durch geringe Modifikationen an der Ribose. Allein gemeinsam ist das Fehlen der 3'-Hydroxygruppe, an der normalerweise die Kettenverlängerung stattfindet. Dies führt nach Einbau der Analoga zu einem Kettenabbruch.
NRTIs gehören zu den ältesten HIV-Medikamenten, als erster Vertreter wurde Zidovudin 1987 zugelassen. Sie entfalten eine mitochondrielle Toxizität, die erste Generation verursachte zahlreiche Nebenwirkungen wie Myelotoxizität oder Polyneuropathien. Dies führte auch dazu, dass manche NRTIs wie Didanosin oder Zalcitabin vom Markt genommen wurden. Moderne NRTIs sind nebenwirkungsärmer. Sie werden über die Niere ausgeschieden und wechselwirken nicht mit anderen Medikamenten. Nachteilig wirken sich starke Kreuzresistenzen aus.
Zu den Einzelsubstanzen zählen: Abacavir (ABC), Zidovoudin (AZT), Lamivudin (3TC), Emtricitabin (FTC) und die nukleotidischen Reverse-Transkriptase-Inhibitoren Tenofovir-Alafenamid-Fumarat (TAF) bzw. Tenofovir-Disoproxil-Fumarat (TDF).
Nichtnukleosidische Reverse-Transkriptase-Inhibitoren (NNRTIs)
Nichtnukleosidische Reverse-Transkriptase-Inhibitoren (NNRTIs)[5] sind Arzneistoffe, die die virale Reverse Transkriptase (RT) inhibieren und damit die Vermehrung von Retroviren hemmen. Sie binden direkt und nichtkompetitiv an die RT, was zu einer Änderung des Enzyms führt – die Polymerisation verläuft signifikant langsamer, die Virusreplikation wird gehemmt. Sie müssen im Gegensatz zu den NRTIs intrazellular nicht aktiviert werden. Resistenzen können schnell entstehen, sollte der Bereich, an denen NNRTIs binden, mutieren.
Die ersten NNRTIs kamen in den 1990er Jahren auf dem Markt. Singulär ist ihre Wirkung äußerst begrenzt, sie werden daher immer in Kombination verabreicht. NNRTIs sind ähnlich effektiv wie HIV-Proteaseinhibitoren, führen aber häufiger zu Kreuzresistenzen und zu einem virologischen Versagen. Daher findet man sie nicht mehr als Erstlinientherapie in vielen Leitlinien, vor Therapiebeginn sollte ein Resistenztest gemacht werden. Spätere Generationen wie das 2019 eingeführte Doravirin wiesen dagegen eine höhere Resistenzbarriere auf.
NNRTIs werden durch Cytochrom P450 verstoffwechselt.
Zu den Einzelsubstanzen zählen: Doravirin, Efavirenz, Etravirin, Nevirapin und Rilpivirin.
Protease-Inhibitoren (PIs)
Protease-Inhibitoren (PIs)[6] besetzen die Bindungsstelle des Substrats an der HIV-Protease und verhindern, dass diese ihre Wirkung entfalten kann. Es können nicht mehr die richtigen Virusbausteine produziert werden, der virale Replikationszyklus wird unterbrochen – es entstehen nichtinfektiöse Viruspartikel. Anfang der 1990er Jahre wurden aufgrund Kenntnisse der dreidimensionalen Struktur zielgerichtete PIs entwickelt, sie tragen alle im Substanznamen die Endsilbe „-navir“. Zu ihren Nebenwirkungen zählen Magen-Darm-Beschwerden, sie tragen zur Lipodystrophie und Dyslipidämie bei. Nachteilig sind ferner die hohen Tablettenzahlen. Dafür bilden sich Resistenzen bei PIs der zweiten Generation vergleichsweise seltener aus, insbesondere wenn sie in ihrer Wirkungsweise durch sogenannte „Booster“ bzw. Pharmakoenhancer (auch Pharmakokinetischer Booster) verstärkt werden.
Diese Wirksteigerung erfolgt mittels Ritonavir oder Cobicistat, die Cytochrom P450 hemmen. Dadurch werden PIs langsamer abgebaut, was sich vorteilhaft auf Maximalkonzentration, Talspiegel und Halbwertszeit auswirkt: die Pillenzahl und damit die tägliche Einnahme sinken. Im Substanznamen wird mittels Zusatz von „/r“ bzw. „/c“ die Art der Boosterung gekennzeichnet.
Zu den Einzelsubstanzen zählen: Atazanavir (Boosterung nicht obligat), Darunavir und Lopinavir/r – obsolet bzw. nicht mehr verwendet werden sollten Saquinvavir und Tipranavir.
Integrase-Strangtransfer-Inhibitoren (INSTIs)
Für die Integration der viralen DNA in die Wirts-DNA des Zellkerns wird eine Integrase benötigt. Diese bindet im Cytoplasma an die virale DNA und bildet den sogenannten Präintegrationskomplex, dieser Vorgang kann durch Pyranodipyrimidine gehemmt werden. Der Präintegrationskomplex wird im zweiten Schritt durch die Integrase prozessiert, wodurch 3'-Hydroxylenden bei der gebundenen DNA geschaffen werden. Hierbei inhibieren Styrylchinolone oder Diketosäuren diesen Prozessierungsschritt. Der vorbereitete Präintegrationskomplex gelangt durch die Kernporen in den Zellkern, es erfolgt der Strangtransfer durch die Integrase – die virale DNA wird gelangt in die menschliche DNA. Schließlich erfolgt die Reparatur der dabei entstandenen Lücken durch wirtseigene Reparaturenzyme, was mittels Methylxanthine gehemmt werden kann.
Zugelassene Integrase-Inhibitoren[7] behindern den Strangtransfer, wodurch die Wirkstoffklasse auch als Integrase-Strangtransfer-Inhibitoren (INSTIs) bezeichnet wird. Substanzen dieser Klasse enthalten die Endsilbe „-tegravir“ im Namen.[8] 2007 wurde Raltegravir als erster INSTI zugelassen.
Über Langzeittoxizitäten sind noch zu wenige Daten verfügbar, INSTIs sind aber kurz- und mittelfristig gut verträglich und wirksam. Dokumentiert sind aber starke Gewichtszunahmen (in Kombination mit TAF) sowie neuropsychiatrische Ereignisse. Die erste Generation von INSTIs weist zudem eine geringe Resistenzschwelle auf.
Zu den Einzelsubstanzen zählen: Cabotegravir, Dolutegravir, Elvitegravir, Raltegravir und Bictegravir (dort nur als Teil eines Eintablettenregimes)
Entry-Inhibitoren

1. Das Oberflächenprotein gp120 bindet an die CD4-Rezeptoren.
2. Konformationsänderung in gp120 ermöglicht eine nachfolgende Interaktion mit CCR5.
3. Die distalen haarnadelartigen Verbindungen von gp41 (grün) dringen in die Zellmembran ein.
4. Durch die Bindung kommt es zu einer Konformationsänderung im Transmembranprotein gp41 („Schnappfedermechanismus“). Dadurch verschmelzen die virale und zelluläre Membranen.
Entry-Inhibitoren unterbinden den Eintritt bestimmter Viren in die Wirtszelle.[9] Die Verschmelzung des HI-Virus mit der Zellmembran der T-Zelle erfolgt zunächst durch die Bindung über das Hüllprotein gp120 an den CD4-Rezeptor der Wirtszelle (vgl. Abbildung Schritt 1). Dadurch wird eine Konformationsänderung und damit „Absenkung“ des gebundenen Virus verursacht, wodurch gp120 mit einem Korezeptor, dem CCR5, interagieren kann (vgl. Abbildung Schritt 2). Im weiteren Verlauf kommt es zu einer Fusion des Virus mit der Zellwandmembran (vgl. Abbildung Schritte 3 und 4).
- Attachment-Inhibitoren verhindern Andocken des HIV-Glykoproteins gp120 an den CD4-Rezeptor. Die Wirkstoffklasse ist uneinheitlich, da sowohl der CD4-Rezeptor als auch die Bindungsstelle von gp120 mit unterschiedlichen Substanzen blockiert werden können. Es sind folgende Einzelsubstanzen verfügbar: Fostemsavir (bindet an gp120) und Ibalizumab (bindet am CD4-Rezeptor, wird nur in den USA vertrieben).
- Korezeptorantagonisten verhindern die Interaktion zwischen den Oberflächenrezeptoren der Zelle und dem viralen Hüllprotein, indem sie die Rezeptorenstellen wie CCR5 und CXCR4 blockieren oder hierfür nachteilig verändern. Sie wurden Mitte der 1990er Jahre entdeckt. Die Korezeptorantagonisten richten sich gegen CCR5, da im frühen Infektionsstadium HIV-Varianten auftreten, die diesen Rezeptor nutzen („R5-Viren“). In späteren Stadien treten dann Varianten auf, die über CXCR4 interagieren („X4-Viren“). Vor der Therapie muss geklärt werden, ob der Einsatz von Korezeptorantagonisten im entsprechenden Krankheitsstadium angebracht ist (Tropismus-Test). Mit Stand 2023 ist Maraviroc der einzige CCR5-Antagonist, er wurde 2007 zugelassen.
- Fusions-Inhibitoren hindern HIV daran, in eine CD4-Zelle einzudringen, indem sie eine Verschmelzung der äußeren Membran des Virus mit der Zellmembran blockieren. Enfuvirtid wurde 2003 zugelassen und gilt als Prototyp dieser Substanzklasse; es wird subktuan appliziert. Nachteilig sind aber die rasche Resistenzbildung, die Nebenwirkungen an der Einstichstelle und der durch die aufwendige Produktion hohe Preis.
Kapsid-Inhibitoren
Das HI-Virus enthält ein konisches Kapsid, in dem sich dessen virales Genom und bestimmte virale Enzyme befinden. Nach Eindringen des Virus in die Zelle wird diese Kapsel geöffnet bzw. „enthüllt“, was für den weiteren Replikationszyklus essentiell ist. Ein Angriffspunkt bei der HIV-Therapie bieten sich infolgedessen Substanzen an, die sich auf die Stabilität des Kapsids auswirken.[10]
2022 wurde Lenacapavir (LEN, Sunlenca, Gilead Sciences) als erste Substanz in dieser Klasse in den USA, Kanada und Europa für Erwachsene mit einer multiresistenten HIV-1-Infektion zugelassen, bei denen kein anderes supprimierendes, antivirales Regime zusammengestellt werden kann. Es wird subkutan appliziert, wonach sich über 6 Monate ein ausreichend hoher Wirkspiegel ausbildet. Lenacapavir wird als Natriumsalz appliziert.[11] Der Hersteller hat sich 2023 entschlossen, Lenacapavir nicht in Deutschland zu vermarkten; angeführt werden Bedenken, einen möglichen Zusatznutzen beim G-BA nicht geltend machen zu können.[12]
Deutsch-Österreichische Leitlinien zur antiretroviralen Therapie der HIV-1-Infektion
Seit September 2020 sieht die AWMF-Leitlinie verschiedene INSTI-, NNRTI- und PI-basierte Ein- und Mehrtablettenregime zur Behandlung von mit HIV-1-infizierten Patienten vor.[1]
Grundsätzlich sollen alle HIV-positive Patienten dauerhaft durch ART behandelt werden.[1] Dies setzt voraus, dass die HIV-Infektion diagnostisch abgesichert ist, die Ausgangsdaten erlauben anschließend die Wahl des passenden Behandlungsregimes. Für die Behandlung muss der Patient ausreichend über Nutzen, Risiken, der Notwendigkeit einer hohen Adhärenz zur Vermeidung von Resistenzen sowie der lebenslangen Medikationseinnahme aufgeklärt und motiviert sein. Die dauerhafte Therapie bedingt zudem gewisse psychosoziale Voraussetzungen, beispielsweise den Versicherungsstatus oder mögliche Unterstützungsangebote.
Die Einleitung der Therapie soll allgemein zeitnah erfolgen, insbesondere bei HIV-positiven Patienten mit erhöhten Risiken (z. B. Akutes Retrovirales Syndrom, Patienten über 50 Jahren oder Schwangere).[1] Ausgenommen sind Patienten mit behandlungsbedürftigen, spezifischen opportunistischen Infektionen (z. B. eine zerebrale Kryptokokkose), die bisher noch nicht mit einer ART behandelt worden sind.
Allgemein dienen bei den Regimen NRTIs als „Rückgrat“ (backbone), bestehen daher also aus mindestens einem, bei therapienaiven Patienten in der Regel zwei NRTIs. Hierbei ist TAF/TDF+FTC (Tenofoviralafenamidfumarat/Tenofovirdisoproxilfumarat + Emtricitabin) führend, gefolgt von ABC+3TC (Abacavir + Lamivudin). Andere Kombinationen sind möglich, aber werden in der Praxis immer seltener eingesetzt. Mittlerweile nicht mehr empfohlen sind Primärtherapien auf Basis von AZT+3TC (schlechte Verträglichkeit, keine einmal tägliche Gabe möglich), AZT+FTC (schlechte Datenbasis), TDF+ABC (Resistenzbildung), FTC+3TC / TDF+TAF / ABC+FTC oder TAF+3TC (Antagonisten). Von Therapien mit d4T, ddI oder ddC wird ausdrücklich abgeraten, diese Substanzen sind mittlerweile vom Markt verschwunden.
Für vorbehandelte Patienten können ferner Dovato und Juluca eingesetzt werden, sie haben jeweils einen oder gar keinen NRTI als Basis.
Zugelassen (Stand 2023) sind folgende Regime:
Eintablettenregime
| Basis | Wirkstoffe | Abkürzung | empfohlene Primärtherapie[1] | Handelsname |
|---|---|---|---|---|
| INSTI | Bictegravir/Tenofoviralafenamid/Emtricitabin | BIC/TAF/FTC | ja | Biktarvy |
| Dolutegravir/Abacavir/Lamivudin | DTG/ABC/3TC | ja | Triumeq | |
| Dolutegravir/Lamivudin | DTG/3TC | ja | Dovato | |
| Dolutegravir/Rilpivirin | DTG/RPV | nein | Juluca | |
| Elvitegravir/Cobicistat/Tenofoviralafenamid/Emtricitabin | EVG/c/TAF/FTC | ja | Genvoya | |
| Elvitegravir/Cobicistat/Tenofovirdisoproxil/Emtricitabin | EVG/c/TDF/FTC | nein | Stribild | |
| NNRTI | Doravirin/Tenofovirdisoproxilfumarat/Lamivudin | DOR/TDF/3TC | ja | Delstrigo |
| Rilpivirin/Tenofovir-Alafenamid/Emtricitabin | RPV/TAF/FTC | ja | Odefsey | |
| Rilpivirin/Tenofovir-Disoproxilfumarat/Emtricitabin | RPV/TDF/FTC | ja | Eviplera | |
| Efavirenz/Tenofovirdisoproxil/Emtricitabin | EFV/TDF/FTC | nein | Atripla | |
| PI | Darunavir/Cobicistat/Tenofovir-Alafenamid/Emtricitabin | DRV/c/TAF/FTC | ja | Symtuza |
Mehrtablettenregime
| Basis | Wirkstoffe | Abkürzung | empfohlene Primärtherapie[1] | Handelsnamen |
|---|---|---|---|---|
| INSTI | Dolutegravir + Tenofovir-Alafenamid/Emtricitabin | DTG + TAF/FTC | ja | Tivicay + Descovy |
| Dolutegravir + Tenofovir-Disoproxilfumarat/Emtricitabin | DTG + TDF/FTC | ja | Tivicay + Truvada | |
| Raltegravir + Abacavir/Lamivudin | RAL + ABC/3TC | ja | Isentress + Kivexa | |
| Raltegravir + Tenofovir-Alafenamid/Emtricitabin | RAL + TAF/FTC | ja | Isentress + Descovy | |
| Raltegravir + Tenofovir-Disoproxilfumarat/Emtricitabin | RAL + TDF/FTC | ja | Isentress + Truvada | |
| NNRTI | Doravirin + Tenofovir-Disoproxilfumarat/Emtricitabin | DOR + TDF/FTC | ja | Pifeltro + Truvada |
| Doravirin + Tenofovir-Alafenamid/Emtricitabin | DOR + TAF/FTC | ja | Pifeltro + Descovy | |
| Doravirin + Abacavir/Lamivudin | DOR + ABC/3TC | ja | Pifeltro + Kivexa | |
| PI | Darunavir/Ritonavir + Abacavir/Lamivudin | DRV/r + ABC/3TC | ja | Prezista + Kivexa |
| Darunavir/Ritonavir + Tenofovir-Alafenamid/Emtricitabin | DRV/r + TAF/3TC | ja | Prezista + Descovy |
Internationale Leitlinien
| Basis | EACS (2023)[13] | WHO (2021)[14] | HHS (2022)[15] | IAS–USA (2022)[16] | BHIVA (2023)[17] |
|---|---|---|---|---|---|
| INSTI | BIC/FTC/TAF | BIC/FTC/TAF | BIC/FTC/TAF | BIC/FTC/TAF | |
| DTG + XTC/TXF | DTG + XTC/TDF | DTG + XTC/TXF | DTG + XTC/TXF | DTG + XTC/TXF | |
| DTG/3TC/ABC | DTG/3TC/ABC | DTG/3TC/ABC | |||
| DTG/3TC oder DTG + XTC | DTG/3TC | DTG/3TC | DTG/3TC | ||
| RAL + XTC/TXF | |||||
| NNRTI | DOR/3TC/TDF oder DOR + XTC/TXF |
International liegen verschiedene Empfehlungen zur Erstlinientherapie bei Patienten mit HIV-1 vor.
Die Empfehlungen der European AIDS Clinical Society (EACS), der WHO, des Ministeriums für Gesundheitspflege und Soziale Dienste der Vereinigten Staaten (HHS), der International Antiviral Society–USA (IAS–USA) der British HIV Association (BHIVA) sind in der Tabelle zusammengefasst.
Nebenwirkungen
Die aktuelle Generation von Medikamenten für eine antiretrovirale Therapie haben ein schwaches Nebenwirkungsprofil. Die gängigsten Nebenwirkungen gehören Kopfschmerzen, Durchfall und Übelkeit (jeweils ≥ 1/100 bis < 1/10 behandelte Personen). Regelmäßig klingen diese leichten Nebenwirkungen nach einigen Wochen ab. Sofern es zu einer dauerhaften oder stärkeren Nebenwirkungsreaktion kommt, sollte eine andere Wirkstoffkombination gewählt werden.[18]
Schutz durch Behandlung
Neben dem Wohlergehen des Patienten durch Reduktion von Krankheitssymptomen hat die Antiretrovirale Therapie einen weiteren wesentlichen Vorteil. Sie wirkt präventiv bei der Verbreitung von HIV. Dieser „Schutz durch Behandlung“ (englisch treatment as prevention, kurz TasP) gilt in vielen Gesundheitssystemen als wichtiger Beitrag, die Wahrscheinlichkeit der HIV-Weiterverbreitung sowie Krankheit oder Tod durch HIV zu senken.
Durch Beobachtungsstudien an serodiskordanten heterosexuellen Paaren ergaben sich in den 2000er Jahren Hinweise auf einen starken Zusammenhang zwischen der HI-Viruslast einer HIV-positiven Person und dem Risiko der sexuellen Übertragung auf eine HIV-negative Person.[19][20][21][22][23] Dies führte zu mehreren größer angelegten Studien, ob eine antiretrovirale Therapie Übertragungsereignisse zwischen Personen verringert, welche die Kernaussage bestätigte: Trotz einer bestehenden HIV-Infektion besteht bei Therapieerfolg, der vollständigen Unterdrückung der HIV-Replikation, ein vernachlässigbares Risiko einer Übertragung von einer Person an eine andere Person.[24][25][26][27]
Aus den Ergebnissen der Studien wurde unter dem Dach der Prevention Access Campaign[28] der Slogan „Undetectable = Untransmittable“ (deutsch in etwa „nicht nachweisbar = nicht übertragbar“[29]) abgeleitet. Die Aussage wird von der Bundeszentrale für gesundheitliche Aufklärung[30], dem Bundesministerium für Soziales, Gesundheit, Pflege und Konsumentenschutz[31], den Centers for Disease Control and Prevention[32] und UNAIDS[33] geteilt. Die Deutsche AIDS-Hilfe weist darauf hin, dass diese Bedeutung einer antiretroviralen Therapie in der Gesamtbevölkerung noch zu unbekannt sei.[34]
Therapie einer HIV-2-Infektion
Wegen der stark verringerten Verbreitung an HIV-2 wurden alle antiretroviralen Medikamente gegen HIV-1 entwickelt. Zudem weist HIV-2 zahlreiche Polymorphismen auf. Infolgedessen zeigen nur wenige Medikamente eine ausreichende Wirksamkeit. Nicht wirksam haben sich alle zugelassenen NNRTIs, die Entry-Inhibitoren Enfuvirtid und Fostemavir sowie die PIs Nelfinavir, Ritonavir, Fosamprenvir, Tipranavir, Indinavir und Atazanavir erwiesen.[35] Dagegen können alle NRTIs, die PIs Darunavir, Lopinavir und Saquinavir (geboostet), alle INSTIs sowie der Entry-Inhibitor Maraviroc bei R5-Tropismus eingesetzt werden.
Forschung
Neue NRTIs
Fozivudintidoxil ist ein Prodrug Zidovudins (AZT) und zeigt eine moderate Wirksamkeit, ist aber in einer zuletzt veröffentlichten Phase 2-Studie in Kombination von 3TC und dem NNRTI Efavirenz so wirksam wie AZT mit weniger Myelotoxizitäten.[36]
Das Cytidinanalogon Elvucitabin ist ein Enantionmer von Dexelvucitabin (Reverset). Es hat eine sehr lange Halbwertszeit von 150 Stunden und ist (in-vitro) gegen viele Resistenzen wirksam. In der 2010 zuletzt veröffentlichten Studie zeigte es eine vergleichbare Wirkung wie 3TC. Ob es weiterentwickelt wird, ist aber unklar.[36]
1999 wurde in Russland Phosphazid (Nikavir) zugelassen, das AZT ähnelt und nach Aktivierung in AZT überführt wird. Ein Vorteil gegenüber AZT ist bei Phosphazid nicht gezeigt.
Neue NNRTIs
Elsulfavirin (VM-1500) wird als Elpida durch das Pharmaunternehmen Viriom in Russland und anderen Ländern zur Behandlung von HIV-1 vertrieben. Es wurde 2017 für die orale Gabe in Kombination mit anderen antiretroviralen Therapien – beispielsweise 3TC oder FTC sowie TDF – in Russland (nicht aber in der EU oder den USA) zugelassen.[37][38] Elsulfavirin selbst ist das Prodrug, das in das pharmakologisch wirksame NNRTI VM-1500A umgesetzt wird.[39] Es hat eine lange Halbwertszeit von 8 Tagen und war in den Studien gut verträglich. Geforscht wird auch an Long-acting-Präparaten.
Neue Entry-Inhibitoren
Neben den oben genannten Entry-Inhibitoren befinden sich eine Reihe von neuer Substanzen dieser Wirkstoffklasse in klinischer Prüfung oder sind in einzelnen Ländern außerhalb Europas zugelassen.
Der peptidische, langwirksame Fusionsinhibitor Albuvirtid wurde 2018 in China unter den Namen Aikening (Frontier Biotechnologies) für HIV-1 zugelassen. Er wird per Injektion appliziert. Der Fusionsinhibitor bindet an das Transmembranprotein gp41 und blockiert dadurch die Fusion mit der Zellmembran der Wirtszelle.[40] Die Zulassung soll auch in andere Länder angestrebt werden, er befindet sich damit weiter in klinischer Prüfung.
Cenicriviroc (CVC, auch bekannt als TBR-652 und vorher TAK-652) ist ein experimenteller oraler Inhibitor der Chemokin-Rezeptoren CCR2 und CCR5.[41] CVC hat eine gute Bioverfügbarkeit, ist gut verträglich und eine mit 35–40 Stunden lange Halbwertszeit. Nachteilig zeigt sich das häufigere virologische Therapieversagen gegenüber Efavirenz. Ob CVC bis zur Marktzulassung weiterentwickelt wird, hängt von seiner Wirksamkeit gegenüber dem CCR5-Inhibitor Maraviroc ab.
Gegen CCR5-Rezeptoren wird Leronlimab entwickelt. Im Gegensatz zu Maraviroc ist es kein Chemokin-Derivat, sondern ein monoklonaler Antikörper, welcher die Bindung von HIV-1 an den CD4-Rezeptor verhindert.[42] Er wird parenteral gegeben und wurde in klinischen Prüfungen gut vertragen. Gegen X4-trope Viren ist Leronlimab allerdings wirkungslos, weswegen der Einsatz als PrEP empfehlenswert ist.[41]
Ein weiterer in klinischer Prüfung befindliche Antikörper ist Semzuvolimab (UB-421). Er blockiert wie Ibalizumab den CD4-Rezeptor, jedoch an dessen CDR2-Domäne. In klinischen Studien zeigten sich keine immunologischen Komplikationen, die CD4-Zellzahl blieb erhalten.[43][41]
Maturationsinhibitoren (MIs)
Maturationsinhibitoren („Reifungshemmer“) hemmen die Knospung neuer Virionen, wodurch einer der letzten Schritte im Replikationszyklus von HIV-1 unterbrochen wird.[44] So verhindert Bevirimat, dass sich die typische Fulleren-ähnliche, konische Struktur des Viruskapsids ausbildet.[45] Dadurch kann keine funktionsfähige Virus-Proteinhülle aufgebaut werden.
Die Entwicklung der Pioniertsubstanz Bevirimat, aber auch der anderer Kandidaten wie GSK-3532795, wurde aufgegeben. Grund hierfür waren die limitierte Wirksamkeit bzw. die schnelle Bildung von Resistenzen. In klinischer Prüfung befindet sich GSK-2838232.
Allosterische Integrase-Inhibitoren (ALLINIs)
Im Gegensatz zu INSTIs binden allosterische Integrase-Inhibitoren (ALLINIs) nicht am katalytisch aktiven Zentrum der HIV-1-Integrase, sondern an einer davon weit entfernten Domäne. Dies stört die Bindung der Integrase an virale HIV-RNA, was den Replikationszyklus wie bei INSTIs behindert. Am weitesten entwickelt ist das sich in klinischer Prüfung befindliche Pirmitegravir (STP0404).
Nukleosidische Reverse-Transkriptase-Translokationsinhibitoren (NRTTIs)
Eine neue Substanzklasse stellen die sogenannten Nukleosidischen RT-Translokationsinhibitoren (NRTTIs) mit der Pioniersubstanz Islatravir (ISL, MK-8591, EFdA) dar. ISL richtet sich gegen die RT von HIV-1. Es wird zu einem Triphosphat umgesetzt und kann so entweder wie klassische NRTIs zum Kettenabbruch führen. Zudem kann ISL nicht durch Exzision wieder aus der RT wieder entfernt werden. Es wechselwirkt aber auch direkt mit der dNTP-Bindungsstelle des Enzyms, was namesgebend die Translokation hemmt. Dadurch werden nachfolgende Nukleotide nicht mehr eingebaut.[46] Aufgrund der geänderten Wirkungsweise im Vergleich zu klassischen NRTIs liegen eigene PK- und Resistenzprofile mit einer hohen Resistenzbarriere vor. So wird seine Wirkung auf Mutationen wie M184V nicht beeinträchtigt. Es wird oral aufgenommen, zeigt eine sehr gute Verträglichkeit und hat eine lange Halbwertszeit von 150 Stunden.
Aufgrund Lymphopenien (CD4-Zellzahlabfall) wurde die klinische Entwicklung unterbrochen und dann mit einer niedrigeren Dosierung wieder aufgenommen.
Siehe auch
- APOBEC3 (Elemente des Immunsystems zur Abwehr von Retrovirus-Infektionen)
- Sexualhygiene
- Stiftung Humanitäre Hilfe für durch Blutprodukte HIV-infizierte Personen
- Kompetenznetz HIV/AIDS
- Breakthrough of the Year, 1996 und 2005
Literatur
Leitlinien
- S2k-Leitlinie HIV-Infektion, antiretrovirale Therapie der Deutschen AIDS-Gesellschaft e.V. (DAIG). In: AWMF online (Stand 2021)
- S2k-Leitlinie HIV-Therapie in der Schwangerschaft und bei HIV-exponierten Neugeborenen der Deutschen AIDS-Gesellschaft e.V. (DAIG). In: AWMF online (Stand 2020)
- WHO (Hrsg.): Guidelines for managing advanced HIV disease and rapid initiation of antiretroviral therapy. World Health Organization, Genf 2017, ISBN 978-92-4155006-2 (englisch, who.int).
- Guidelines version 12.0. (PDF) European AIDS Clinical Society (EACS), Oktober 2023, abgerufen am 23. Oktober 2023 (englisch).
- Leitlinien Version 10.0. (PDF) European AIDS Clinical Society (EACS), November 2019, abgerufen am 13. April 2023.
Fachliteratur
- Christian Hoffmann, Jürgen K. Rockstroh (Hrsg.): HIV 2022/2023. Medizin Fokus Verlag, Hamburg 2022, ISBN 978-3-941727-28-1 (hivbuch.de [PDF]).
- Kathrin van Bremen, Christoph Boesecke: Blick in die Pipeline: Diese neuen HIV-Medikamente werden entwickelt. In: MMW – Fortschritte der Medizin. Band 164, Nr. 2, 1. Juni 2022, S. 56–62, doi:10.1007/s15006-022-1018-5.
- Inês Moranguinho et al.: Antiretroviral Treatment of HIV-2 Infection: Available Drugs, Resistance Pathways, and Promising New Compounds. In: International Journal of Molecular Sciences. Band 24, Nr. 6, 21. März 2023, S. 5905, doi:10.3390/ijms24065905, PMID 36982978 (englisch).
- Ulrich Baumann et al.: HIV-Infektion und -Exposition bei Kindern und Jugendlichen. In: Die Gynäkologie. Band 56, Nr. 1, 1. Januar 2023, S. 47–57, doi:10.1007/s00129-022-05046-w, PMC 9748901 (freier Volltext).
Weblinks
- HIV (AIDS), RKI, 16. Februar 2023
- EACS Guidelines (englisch), European AIDS Clinical Society / EACS
- Persons with HIV: Prevention and Care (englisch), Centers for Disease Control and Prevention (CDC)
- HIV-Medikamente, Deutsche Aidshilfe
- National HIV Curriculum (englisch), National HIV Curriculum (University of Washington)
- HIV Drug Resistance Mutations (englisch), International Aids Society USA
Einzelnachweise
- ↑ a b c d e f g Deutsche AIDS-Gesellschaft (Hrsg.): Deutsch-Österreichische Leitlinien zur antiretroviralen Therapie der HIV-1-Infektion. 8. Auflage. 3. September 2020 (awmf.org [PDF; abgerufen am 14. März 2023]).
- ↑ S2k-Leitlinie HIV-Infektion, antiretrovirale Therapie der Deutschen AIDS-Gesellschaft e.V. (DAIG). In: AWMF online (Stand 2014)
- ↑ HIV 2022/2023. (PDF) In: hivbuch.de. Jürgen Rockstroh, Christian Hoffmann, abgerufen am 1. Mai 2023.
- ↑ Christian Hoffmann: Substanzklassen, Medikamentenübersicht. In: Jürgen Rockstroh, Christian Hoffmann (Hrsg.): HIV 2022/2023. Medizin Fokus Verlag, Hamburg 2022, ISBN 978-3-941727-28-1, S. 52–64 (hivbuch.de [PDF]).
- ↑ Christian Hoffmann: Substanzklassen, Medikamentenübersicht. In: Jürgen Rockstroh, Christian Hoffmann (Hrsg.): HIV 2022/2023. Medizin Fokus Verlag, Hamburg 2022, ISBN 978-3-941727-28-1, S. 65–71 (hivbuch.de [PDF]).
- ↑ Christian Hoffmann: Substanzklassen, Medikamentenübersicht. In: Jürgen Rockstroh, Christian Hoffmann (Hrsg.): HIV 2022/2023. Medizin Fokus Verlag, Hamburg 2022, ISBN 978-3-941727-28-1, S. 72–79 (hivbuch.de [PDF]).
- ↑ Christian Hoffmann: Substanzklassen, Medikamentenübersicht. In: Jürgen Rockstroh, Christian Hoffmann (Hrsg.): HIV 2022/2023. Medizin Fokus Verlag, Hamburg 2022, ISBN 978-3-941727-28-1, S. 80–88 (hivbuch.de [PDF]).
- ↑ The use of stems in the selection of International Nonproprietary Names (INN) for pharmaceutical substances. (PDF) In: WHO. 2018, S. 191, abgerufen am 30. Mai 2023 (englisch).
- ↑ Christian Hoffmann: Substanzklassen, Medikamentenübersicht. In: Jürgen Rockstroh, Christian Hoffmann (Hrsg.): HIV 2022/2023. Medizin Fokus Verlag, Hamburg 2022, ISBN 978-3-941727-28-1, S. 89–97 (hivbuch.de [PDF]).
- ↑ Christian Hoffmann: Substanzklassen, Medikamentenübersicht. In: Jürgen Rockstroh, Christian Hoffmann (Hrsg.): HIV 2022/2023. Medizin Fokus Verlag, Hamburg 2022, ISBN 978-3-941727-28-1, S. 98–99 (hivbuch.de [PDF]).
- ↑ Patrick Braun: LENACAPAVIR, der erste First-in-Class-Kapsid-Inhibitor: So nah und doch noch fern… (PDF) In: Retroviren Bulletin. 2023, S. 2–5, abgerufen am 5. September 2023.
- ↑ Stellungnahme zu Lenacapavir in Deutschland. In: Gilead. 2. Mai 2023, abgerufen am 5. Mai 2023.
- ↑ Guidelines. (PDF) Version 12. In: European AIDS Clinical Society. Oktober 2023, S. 13, abgerufen am 23. Oktober 2023 (englisch).
- ↑ Consolidated guidelines on HIV prevention, testing, treatment, service delivery and monitoring: recommendations for a public health approach. (PDF) In: WHO. Juli 2021, abgerufen am 23. Oktober 2023 (englisch).
- ↑ Panel on Antiretroviral Guidelines for Adults and Adolescents: Guidelines for the Use of Antiretroviral Agents in Adults and Adolescents with HIV. (PDF) Ministerium für Gesundheitspflege und Soziale Dienste der Vereinigten Staaten, 21. September 2022, S. G-1, abgerufen am 23. Oktober 2023 (englisch).
- ↑ Rajesh T. Gandhi et al.: Antiretroviral Drugs for Treatment and Prevention of HIV Infection in Adults: 2022 Recommendations of the International Antiviral Society-USA Panel. In: JAMA. Band 329, Nr. 1, 3. Januar 2023, S. 63–84, doi:10.1001/jama.2022.22246, PMID 36454551 (englisch).
- ↑ Laura Waters, Alan Winston, Iain Reeves et al.: BHIVA guidelines on antiretroviral treatment for adults living with HIV-1 2022 (2023 interim update). (PDF) In: British HIV Association. 2023, S. 16, abgerufen am 23. Oktober 2023 (englisch).
- ↑ Deutsche AIDS-Hilfe: Nebenwirkungen. In: aidshilfe.de. 17. Februar 2010, abgerufen am 8. Dezember 2020.
- ↑ Thomas C. Quinn, Maria J. Wawer, Nelson Sewankambo, David Serwadda, Chuanjun Li: Viral Load and Heterosexual Transmission of Human Immunodeficiency Virus Type 1. In: New England Journal of Medicine. Band 342, Nr. 13, 30. März 2000, ISSN 0028-4793, S. 921–929, doi:10.1056/NEJM200003303421303, PMID 10738050.
- ↑ Jesús Castilla, Jorge del Romero, Victoria Hernando, Beatriz Marincovich, Soledad García, Carmen Rodríguez: Effectiveness of Highly Active Antiretroviral Therapy in Reducing Heterosexual Transmission of HIV:. In: JAIDS Journal of Acquired Immune Deficiency Syndromes. Band 40, Nr. 1, September 2005, ISSN 1525-4135, S. 96–101, doi:10.1097/01.qai.0000157389.78374.45 (lww.com [abgerufen am 8. Dezember 2020]).
- ↑ Marineide Gonçalves Melo, Breno Riegel Santos, Rita De Cassia Lira, Ivana S. Varella, Maria Lourdes Turella: Sexual Transmission of HIV-1 Among Serodiscordant Couples in Porto Alegre, Southern Brazil. In: Sexually Transmitted Diseases. Band 35, Nr. 11, November 2008, ISSN 0148-5717, S. 912–915, doi:10.1097/OLQ.0b013e31817e2491 (lww.com [abgerufen am 8. Dezember 2020]).
- ↑ Suzanna Attia, Matthias Egger, Monika Müller, Marcel Zwahlen, Nicola Low: Sexual transmission of HIV according to viral load and antiretroviral therapy: systematic review and meta-analysis. In: AIDS. Band 23, Nr. 11, 17. Juli 2009, ISSN 0269-9370, S. 1397–1404, doi:10.1097/QAD.0b013e32832b7dca (lww.com [abgerufen am 8. Dezember 2020]).
- ↑ Deborah Donnell, Jared M Baeten, James Kiarie, Katherine K Thomas, Wendy Stevens: Heterosexual HIV-1 transmission after initiation of antiretroviral therapy: a prospective cohort analysis. In: The Lancet. Band 375, Nr. 9731, Juni 2010, S. 2092–2098, doi:10.1016/S0140-6736(10)60705-2, PMID 20537376, PMC 2922041 (freier Volltext) – (elsevier.com [abgerufen am 8. Dezember 2020]).
- ↑ Reuben Granich, Somya Gupta, Amitabh B Sutha, Caoimhe Smyth, David Hoos: Antiretroviral Therapy in Prevention of HIV and TB: Update on Current Research Efforts. In: Current HIV Research. Band 9, Nr. 6, September 2011, ISSN 1570-162X, S. 446–469, doi:10.2174/157016211798038597, PMID 21999779, PMC 3531820 (freier Volltext) – (eurekaselect.com [abgerufen am 8. Dezember 2020]).
- ↑ Myron S. Cohen, Ying Q. Chen, Marybeth McCauley, Theresa Gamble, Mina C. Hosseinipour: Prevention of HIV-1 Infection with Early Antiretroviral Therapy. In: New England Journal of Medicine. Band 365, Nr. 6, 11. August 2011, ISSN 0028-4793, S. 493–505, doi:10.1056/nejmoa1600693, PMID 21767103, PMC 3200068 (freier Volltext).
- ↑ Marie-Claude Boily, Benoît Mâsse, Ramzi Alsallaq, Nancy S. Padian, Jeffrey W. Eaton: HIV Treatment as Prevention: Considerations in the Design, Conduct, and Analysis of Cluster Randomized Controlled Trials of Combination HIV Prevention. In: PLOS Medicine. Band 9, Nr. 7, 7. Oktober 2012, ISSN 1549-1676, 1001250, doi:10.1371/journal.pmed.1001250, PMID 22807657, PMC 3393676 (freier Volltext) – (plos.org [abgerufen am 8. Dezember 2020]).
- ↑ Alison J. Rodger, Valentina Cambiano, Tina Bruun, Pietro Vernazza, Simon Collins: Risk of HIV transmission through condomless sex in serodifferent gay couples with the HIV-positive partner taking suppressive antiretroviral therapy (PARTNER): final results of a multicentre, prospective, observational study. In: The Lancet. Band 393, Nr. 10189, Juni 2019, S. 2428–2438, doi:10.1016/S0140-6736(19)30418-0, PMID 31056293, PMC 6584382 (freier Volltext) – (elsevier.com [abgerufen am 8. Dezember 2020]).
- ↑ Prevention Access Campaign: Hauptseite. Abgerufen am 8. Dezember 2020 (englisch).
- ↑ HIV-Infektion/AIDS. RKI-Ratgeber. In: RKI. 16. Juni 2022, abgerufen am 14. März 2023.
- ↑ Bundeszentrale für gesundheitliche Aufklärung: HIV-Therapie. In: liebesleben.de. Abgerufen am 8. Dezember 2020.
- ↑ Bundesministerium für Soziales, Gesundheit, Pflege und Konsumentenschutz: HIV/AIDS: Kinderwunsch – HIV-positive Partnerin/HIV-negativer Partner. In: gesundheit.gv.at. 28. Juni 2018, abgerufen am 8. Dezember 2020.
- ↑ Centers for Disease Control and Prevention: HIV Treatment as Prevention. In: cdc.gov. 6. April 2020, abgerufen am 8. Dezember 2020 (amerikanisches Englisch).
- ↑ UNAIDS: Public health and HIV viral load suppression. 19. Juli 2017, abgerufen am 8. Dezember 2020 (englisch).
- ↑ Marcel Hackbart, Barbara Thies: HIV-Stigma: Was kann die Aufklärung über Schutz durch Therapie bewirken? In: magazin.hiv. 17. August 2020, abgerufen am 8. Dezember 2020.
- ↑ Dirk Berzow und Christian Hoffmann: Die HIV-2-Infektion. In: Jürgen Rockstroh, Christian Hoffmann (Hrsg.): HIV 2022/2023. Medizin Fokus Verlag, Hamburg 2022, ISBN 978-3-941727-28-1, S. 476–477 (hivbuch.de [PDF]).
- ↑ a b Christian Hoffmann: ART 2024+: Hinterm Horizont geht’s weiter. In: Jürgen Rockstroh, Christian Hoffmann (Hrsg.): HIV 2022/2023. Medizin Fokus Verlag, Hamburg 2022, ISBN 978-3-941727-28-1, S. 103 ff. (hivbuch.de [PDF]).
- ↑ Zaina T. Al-Salama: Elsulfavirine: First Global Approval. In: Drugs. Band 77, Nr. 16, Oktober 2017, S. 1811–1816, doi:10.1007/s40265-017-0820-3, PMID 28940154 (englisch).
- ↑ Elpida (elsulfavirine) becomes the preferred first line therapy for treatment of HIV infection in Russia. In: Pressebericht Viriom. 2. Februar 2021, abgerufen am 14. August 2023 (englisch).
- ↑ Luis Menéndez-Arias et al.: An Update on Antiretroviral Therapy. In: Advances in Experimental Medicine and Biology. Band 1322, 2021, S. 31–61, doi:10.1007/978-981-16-0267-2_2, PMID 34258736 (englisch).
- ↑ Albuvirtide. In: NIH. 4. April 2023, abgerufen am 12. August 2023 (englisch).
- ↑ a b c Christian Hoffmann: ART 2024+: Hinterm Horizont geht’s weiter. In: Jürgen Rockstroh, Christian Hoffmann (Hrsg.): HIV 2022/2023. Medizin Fokus Verlag, Hamburg 2022, ISBN 978-3-941727-28-1, S. 111 ff. (hivbuch.de [PDF]).
- ↑ Jeffrey M. Jacobson et al.: Phase 2a Study of the CCR5 Monoclonal Antibody PRO 140 Administered Intravenously to HIV-Infected Adults. In: Antimicrobial Agents and Chemotherapy. Band 54, Nr. 10, Oktober 2010, S. 4137–4142, doi:10.1128/AAC.00086-10, PMID 20660677, PMC 2944554 (freier Volltext) – (englisch).
- ↑ Semzuvolimab. NIH, 14. Oktober 2022, abgerufen am 12. August 2023 (englisch).
- ↑ Christian Hoffmann: ART 2024+: Hinterm Horizont geht’s weiter. In: Jürgen Rockstroh, Christian Hoffmann (Hrsg.): HIV 2022/2023. Medizin Fokus Verlag, Hamburg 2022, ISBN 978-3-941727-28-1, S. 123 (hivbuch.de [PDF]).
- ↑ Alicia Regueiro-Ren et al.: The Discovery of GSK3640254, a Next-Generation Inhibitor of HIV-1 Maturation. In: Journal of Medicinal Chemistry. Band 65, Nr. 18, 22. September 2022, S. 11927–11948, doi:10.1021/acs.jmedchem.2c00879, PMID 36044257 (englisch).
- ↑ Eva Wolf, Patrick Braun: Resistenzen und Tropismus. In: Jürgen Rockstroh, Christian Hoffmann (Hrsg.): HIV 2022/2023. Medizin Fokus Verlag, Hamburg 2022, ISBN 978-3-941727-28-1, S. 266; 103–104 (hivbuch.de [PDF]).
Auf dieser Seite verwendete Medien
Autor/Urheber: Jmarchn, Lizenz: CC BY-SA 3.0
Mechanismen vier verschiedener Wirkstoffklassen antiretroviraler Medikamenten gegen HIV
Autor/Urheber: Mike Jones, Lizenz: CC BY-SA 3.0
Mechanism of Viral Entry/Membrane Fusion
1. Initial interaction between gp120 and CD4. 2. Conformational change in gp120 allows for secondary interaction with CXCR4. 3. The distal tips of gp41 are inserted in to the cellular membrane.
4. gp41 undergoes significant conformational change; folding in half and forming coiled-coils. This process pulls the viral and cellular membranes together, fusing them.