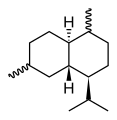
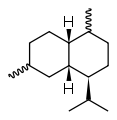
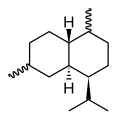
Cadinene

Die Cadinene (Betonung auf der dritten Silbe: Cadinene) sind eine Gruppe chiraler Verbindungen, die sich durch die Lage der Doppelbindungen im Molekül, die Konfiguration der Stereozentren und die Verknüpfung der beiden Cyclohexanringe unterscheiden. Es sind ungesättigte bicyclische Kohlenwasserstoffe und gehören zur Reihe der Sesquiterpene. Allen liegt die Struktur der gesättigten Stammverbindung, dem Cadinan, zugrunde.
Die Bezeichnung leitet sich ab von Juniperus oxycedrus (franz. Cade oder Genévrier cade, Stech-Wacholder), aus dessen Holz erstmals Cadinene isoliert wurden.
In Abhängigkeit von der stereochemischen Konfiguration werden die einzelnen Vertreter der Stoffgruppe auch als Muurolene, Amorphene oder Bulgarene bezeichnet.
Vertreter
Die bei drei stereogenen Zentren acht möglichen Stereo-Isomeren sind alle bekannt, das bedeutendste und gleichzeitig das häufigste Sesquiterpen überhaupt ist (−)-β-Cadinen (Spezifischer Drehwert: [α]D20= −251°).[1] Es ist ein Hexahydro-Derivat des 4-Isopropyl-1,6-dimethylnaphthalins (Cadalin), die gesättigte Stammverbindung ist als Cadinan bekannt.
| Cadinene | ||||||
| Name | α-Cadinen | β-Cadinen | γ-Cadinen | δ-Cadinen | ε-Cadinen | |
| Andere Namen | (1S,4aR,8aS)- 1-Isopropyl-4,7- dimethyl- 1,2,4a,5,8,8a-hexahydronaphthalen | γ-Muurolen | δ-Amorphen | ε-Muurolen | ||
| Strukturformel | 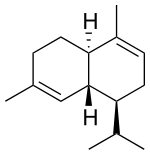 |  |  |  |  | |
| CAS-Nummer | 24406-05-1 | 523-47-7 | 1460-97-5 [(–)-γ-Cadinen] 39029-41-9 | 483-76-1 | 1080-67-7 2535-42-4 20307-98-6 29887-40-9 | |
| ? (Isomerengemisch) | ||||||
| PubChem | 12306048 101708 | 3032853 | 15094 6429304 6432404 92313 10512446 6432308 5315591 | 10223 441005 12306055 | 5315590 520461 | |
| Summenformel | C15H24 | |||||
| Molare Masse | 204,39 g·mol−1 | |||||
| Aggregatzustand | flüssig | |||||
| Kurzbeschreibung | farbloses Öl von angenehmem Geruch[1] | |||||
| Schmelzpunkt | ||||||
| Siedepunkt | 275 °C[1] | |||||
| Dichte | 0,92 g·cm−3[1] | |||||
| Löslichkeit | in Wasser nahezu unlöslich[1] | |||||
| GHS- Kennzeichnung [2] |
| |||||
| H- und P-Sätze | siehe oben | |||||
| siehe oben | ||||||
| siehe oben | ||||||
Stereochemie
Je nach Verknüpfung der beiden Cyclohexan-Ringe des Dekalins werden in Abhängigkeit von der absoluten stereochemischen Konfiguration die einzelnen Vertreter der Stoffgruppe auch als Muurolene, Amorphene oder Bulgarene bezeichnet.
- Konfiguration der Cadinene
- Konfiguration der Muurolene
- Konfiguration der Amorphene
- Konfiguration der Bulgarene
Cadinene sind gegenüber Licht empfindlich und sollten daher an dunklen Orten aufbewahrt werden.
Vorkommen und Gewinnung

α-Cadinen findet sich in Gamander (Teucrium cyprium und Teucrium kotschyanum)[3] β-Cadinen ist in den Blättern mancher Gamander-Arten, in Ageratum (Ageratum conyzoides),[4] in Beifuß (Artemisia annua)[4] sowie im Wermutkraut[5] zu finden. Es ist der Hauptbestandteil des Cade-Öls, das durch trockene Destillation von Wacholderholz (Juniperus oxycedrus) im Mittelmeerraum gewonnen wird. Das Isomer γ-Cadinen kommt in Anis-Duftnessel,[6] Basilikum (Ocimum basilicum),[7] Tamarindenbaum (Tamarindus indica),[7] Ageratum (Ageratum conyzoides),[7] der Waldkiefer (Pinus sylvestris),[7] dem Eukalyptus (Eucalyptus globulus)[7] und Goldrute-Arten vor. δ-Cadinen findet sich in größeren Mengen in Helmkräutern (Scutellaria lateriflora)[8], sowie Basilikum (Ocimum basilicum,[8] Ocimum tenuiflorum[9]) Waldkiefer (Pinus sylvestris),[8] Teebaum (Melaleuca alternifolia)[8] und im Kubeben-Pfeffer (Piper cubeba),[8] zu finden. Auch in dem von Bienen produzierten Propolis konnten γ- und δ-Cadinen und nachgewiesen werden.[10]
Verwendung
- Salben gegen Hautausschläge
- Teerseifen
- Haarsalben
- β-Cadinen wird als Geschmackstoff in Backwaren, Süßigkeiten und Kaugummi sowie als Duftstoff in Kosmetika und Detergentien verwendet.
Einzelnachweise
- ↑ a b c d e Eintrag zu Cadinen. In: Römpp Online. Georg Thieme Verlag, abgerufen am 8. Juni 2014.
- ↑ In Bezug auf ihre Gefährlichkeit wurde die Substanz von der EU noch nicht eingestuft, eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ ALPHA-CADINENE (englisch). In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture, abgerufen am 11. Juli 2021.
- ↑ a b BETA-CADINENE (englisch). In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture, abgerufen am 11. Juli 2021.
- ↑ Otto Vostrowsky, Thorolf Brosche, Helmut Ihm, Robert Zintl, Karl Knobloch: Über die Komponenten des ätherischen Öls aus Artemisia absinthium L.. In: Zeitschrift für Naturforschung C. 36, 1981, S. 369–377 (PDF, freier Volltext).
- ↑ G. R. Mallavarapu, R. N. Kulkarni, K. Baskaran, S. Ramesh: The essential oil composition of anise hyssop grown in India. In: Flavour and Fragrance Journal. Band 19, Nr. 4, Juli 2004, S. 351–353, doi:10.1002/ffj.1316.
- ↑ a b c d e GAMMA-CADINENE (englisch). In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture, abgerufen am 11. Juli 2021.
- ↑ a b c d e DELTA-CADINENE (englisch). In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture, abgerufen am 11. Juli 2021.
- ↑ (+)-DELTA-CADINENE (englisch). In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture, abgerufen am 11. Juli 2021.
- ↑ F. Pellati, F. P. Prencipe, S. Benvenuti: Headspace solid-phase microextraction-gas chromatography-mass spectrometry characterization of propolis volatile compounds. In: Journal of Pharmaceutical and Biomedical Analysis. Band 84, Oktober 2013, S. 103–111, doi:10.1016/j.jpba.2013.05.045. PMID 23807002.
Auf dieser Seite verwendete Medien
Struktur von β-Cadinen
Autor/Urheber: Tigerente, Lizenz: CC BY-SA 3.0
Juniperus oxycedrus, Sa Talaia ~100m, Ibiza
Struktur von ε-Cadinen
Struktur von δ-Cadinen
Struktur von γ-Cadinen
Struktur von α-Cadinen