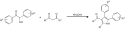Ammoniumacetat
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
  | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Ammoniumacetat | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel | C2H7NO2 | |||||||||||||||
| Kurzbeschreibung | farblose Kristalle[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 77,08 g·mol−1 | |||||||||||||||
| Aggregatzustand | fest | |||||||||||||||
| Dichte | 1,17 g·cm−3[3] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | Zersetzung ab 90 °C[3] | |||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Ammoniumacetat, CH3COONH4, ist das Ammoniumsalz der Essigsäure. Es bildet farblose, schwach nach Essigsäure riechende Kristalle, die sich sehr gut in Wasser und gut in Ethanol lösen. Im festen Zustand bildet es eine hygroskopische Masse, die in Lösung neutral reagiert.
Geschichte
Die wässrige Lösung wurde als essigsaurer Ammoniak oder Spiritus Mindereri bereits 1620 vom deutschen Militärarzt in Augsburg Raymund Minderer als Arzneimittel beschrieben.[6][7] Nach Ernst Friedrich Anthon wurde es 1833 als acetas ammoniae bzw. wegen seiner hygroskopischen Eigenschaften als sal ammoniacus liquidus bezeichnet.[8]
Synthese
Ammoniumacetat lässt sich durch Umsetzung von Ammoniumcarbonat oder Ammoniak mit Eisessig gewinnen.
Verwendung
Verwendung findet das Ammoniumacetat in der Färberei, bei der Fleischkonservierung und in der biochemischen Laborarbeit. Im Labor wird es zur Herstellung von Pufferlösungen zur Stabilisierung des pH-Werts verwendet. Die Dissoziationskonstanten von Ammoniak und Essigsäure in Wasser sind nahezu identisch; Lösungen von Ammoniumacetat haben deshalb relativ unabhängig von der Konzentration einen pH-Wert von 7,0[9]. In der Mikroskopie wird es in Mischung mit Gummi arabicum als Einschlussmittel zur Herstellung von Dauerpräparaten eingesetzt.
In der Gentechnik wird die DNA manchmal mit Hilfe von Ammoniumacetat ausgefällt. Im Gegensatz zu Natriumacetat werden so keine Oligonukleotide und keine freien dNTPs mitgefällt, so dass auf diese Art gefällte DNA für die Transfektion von Säugerzellen besser geeignet ist. Sie ist allerdings nicht geeignet, wenn später Kinasen verwendet werden sollen.
Reaktionen
Beim Erhitzen zerfällt Ammoniumacetat unter Wasserabspaltung zu Acetamid.[10]
In der organischen Synthese wird die Verbindung als Reagenz zur Einführung von Stickstoff in organische Moleküle verwendet.[10] Die Umsetzung mit Alkoholen ergibt tertiäre Amine.[11][10]
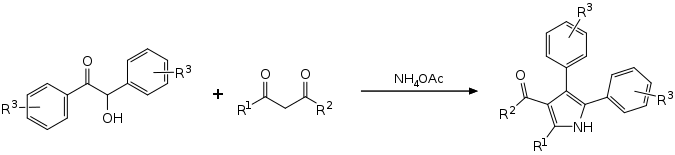
Eine Eintopfreaktion mit substituierten Benzoinen, 1,3-Dicarbonylverbindungen und Ammoniumacetat führt ohne Lösungsmittel und Katalysator zu tetrasubstituierten Pyrrolen.[12][10]
Als Variante der Hantzschschen Dihydropyridinsynthese können durch die Umsetzung von β-Ketocarbonsäureestern, Aldehyden und Ammoniumacetat substituierte 1,4-Dihydropyridine erhalten werden.[13][10]
Einzelnachweise
- ↑ Eintrag zu AMMONIUM ACETATE in der CosIng-Datenbank der EU-Kommission, abgerufen am 1. November 2021.
- ↑ Europäisches Arzneibuch 10.0. Deutscher Apotheker Verlag, 2020, ISBN 978-3-7692-7515-5, S. 701.
- ↑ a b c d e f Eintrag zu Ammoniumacetat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 19. Dezember 2019. (JavaScript erforderlich)
- ↑ a b C. Le Berre; P. Serp; P. Kalck; G.P. Torrence: Acetic Acid, in: Ullmanns Enzyklopädie der Technischen Chemie, Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim 2013; doi:10.1002/14356007.a01_045.pub3.
- ↑ Eintrag zu Ammoniumacetat. In: Römpp Online. Georg Thieme Verlag, abgerufen am 29. September 2014.
- ↑ Rolf Werner Soukup: Chemiegeschichtliche Daten anorganischer Substanzen, Version 2020, S. 9 pdf.
- ↑ R. Minderer: Medicina militaris seu libellus castrensis euporista et facile parabilia medicamenta continens. Id est: Gemaine Handstücklein zur Kriegs Artzney gehörig. Mit wolgegründten Experimenten gezieret, und den gemainen Soldaten, Ritter und Knechten zum nutzen an Tag gegeben. Aperger, Augsburg 1620, digital.
- ↑ Ernst Friedrich Anthon: Handwörterbuch der chemisch-pharmazeutischen und pharmakognostischen Nomenklaturen: oder Uebersicht aller lateinischen, deutschen und französischen Benennungen der chemisch-pharmazeutischen Präparate, so wie der im Handel vorkommenden rohen Arzneistoffe, für Aerzte, Apotheker und Droguisten. Schrag, 1833.
- ↑ R. J. Williams, C. M. Lyman: A Neutral Buffered Standard for Hydrogen Ion Work and Accurate Titrations Which Can be Prepared in One Minute. In: J. Am. Chem. Soc. 54(5), 1932, S. 1911–1912. doi:10.1021/ja01344a025
- ↑ a b c d e Ammonium acetate. In: e-EROS Encyclopedia of Reagents for Organic Synthesis. John Wiley and Sons, 1999–2013, abgerufen am 17. Februar 2018.
- ↑ R. Yamaguchi, S. Kawagoe, C. Asai, K. Fujita: Selective Synthesis of Secondary and Tertiary Amines by Cp*Iridium-Catalyzed Multialkylation of Ammonium Salts with Alcohols. In: Org. Lett. 10, 2008, S. 181–184. doi:10.1021/ol702522k.
- ↑ S. I. Bhat, D. R. Trivedi: A catalyst- and solvent-free three-component reaction for the regioselective one-pot access to polyfunctionalized pyrroles. In: Tetrahedron Lett. 54, 2013, S. 5577–5582. doi:10.1016/j.tetlet.2013.07.153.
- ↑ K. Azizi, J. Azarnia, M. Karimi, E. Yazdani, A. Heydari: Novel Magnetically Separable Sulfated Boric Acid Functionalized Nanoparticles for Hantzsch Ester Synthesis. In: Synlett. 27, 2016, S. 1810–1813. doi:10.1055/s-0035-1561441.
Auf dieser Seite verwendete Medien
Struktur des Acetat-Ions
synthesis of dihydropyridines from β–ketoesters, aldehydes and ammonium acetate
Synthesis of tetrasubstituted pyrroles from benzoin derivates, 1,3-dicarbonyls and ammonium acetate