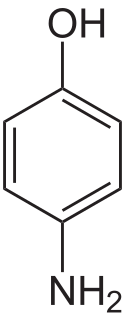
Aminophenole
Aminophenole (auch Hydroxyaniline; Summenformel C6H7NO) sind aromatische Verbindungen und leiten sich sowohl vom Anilin als auch vom Phenol ab. Durch unterschiedliche Anordnung der Substituenten ergeben sich drei Konstitutionsisomere. Sie dienen u. a. zur Herstellung von Arzneimitteln, Farbstoffen und photographischen Entwicklern. Die Methylether bilden die Gruppe der Anisidine, die Ethylether die der Phenetidine.
Vertreter
| Aminophenole | |||||||||
| Name | 2-Aminophenol | 3-Aminophenol | 4-Aminophenol | ||||||
| Andere Namen | o-Aminophenol, 2-Hydroxyanilin | m-Aminophenol, 3-Hydroxyanilin M-AMINOPHENOL (INCI)[1] | p-Aminophenol, 4-Hydroxyanilin | ||||||
| Strukturformel |  |  | |||||||
| CAS-Nummer | 95-55-6 | 591-27-5 | 123-30-8 | ||||||
| 27598-85-2 (Isomerengemisch)[2] | |||||||||
| ECHA-InfoCard | 100.002.211 | 100.008.830 | 100.004.198 | ||||||
| PubChem | 5801 | 11568 | 403 | ||||||
| Summenformel | C6H7NO | ||||||||
| Molare Masse | 109,13 g·mol−1 | ||||||||
| Aggregatzustand | fest | ||||||||
| Kurzbeschreibung | farbloser Feststoff | ||||||||
| Schmelzpunkt | 172–174 °C[3] | 122 °C[4] | 190 °C[5] | ||||||
| Siedepunkt | 150 °C (15 mbar)[3] | 164 °C (15 mbar)[4] | 284 °C (Zers.)[5] | ||||||
| pKs-Wert | 4,78 (20 °C, Aminogruppe)[6] 9,97 (20 °C, Hydroxygruppe)[6] | 4,37 (20 °C, Aminogruppe)[6] 9,82 (20 °C, Hydroxygruppe)[6] | 5,48 (25 °C, Aminogruppe)[6] 10,30 (25 °C, Hydroxygruppe)[6] | ||||||
| Löslichkeit | 17 g·l−1 (20 °C)[3] | 26 g·l−1 (20 °C)[4] | 6,5 g·l−1 (24 °C)[5] | ||||||
| wenig löslich in Wasser, löslich in Ethanol, Ether, Säuren und Basen | |||||||||
| GHS- Kennzeichnung | |||||||||
aus Verordnung (EG) Nr. 1272/2008 (CLP),[7] ggf. erweitert
| aus Verordnung (EG) Nr. 1272/2008 (CLP),[8] ggf. erweitert
| aus Verordnung (EG) Nr. 1272/2008 (CLP),[9] ggf. erweitert
| |||||||
| H- und P-Sätze | 302‐332‐317‐341[3] | 302‐332‐317‐411[4] | 302‐332‐317‐341‐373‐410[5] | ||||||
| keine EUH-Sätze | keine EUH-Sätze | keine EUH-Sätze | |||||||
| 280‐301+330+331‐302+352‐304+340‐312‐333+313[3] | 272‐273‐280‐301+312‐302+352‐304+340+312[4] | 273‐280‐301+312‐302+352‐304+340+312‐308+313[5] | |||||||
| Tox-Daten | 951 mg·kg−1 (LD50, Ratte, oral)[3] | 924 mg·kg−1 (LD50, Ratte, oral)[4] | 375 mg·kg−1 (LD50, Ratte, oral)[5] | ||||||
Namensgebung
Im Gegensatz zu zahlreichen disubstituierten Benzolen hat sich für die Aminophenole kein eigener Trivialname herausgebildet.
So wie sich die Anisidine vom Namensstamm Anisol bzw. Toluidine von Toluol ableiten (stickstoffhaltige Derivate des Anisols bzw. Toluols), hätte man in analoger Weise ausgehend vom Namensstamm Phenol die Namensgebung Phenidine ableiten können. Dazu ist es jedoch nicht gekommen, der Name Phenidin wird hingegen für das N-(4-ethoxyphenyl)acetamid (= Phenacetin) verwendet.
Eigenschaften
Die Aminophenole sind feste farblose Stoffe. Sie verfärben sich bei Einwirkung von Luft grau bis dunkelgrau. Sie sind wenig löslich in Wasser, löslich in Ethanol und Ether. Da sie sowohl eine Hydroxygruppe als auch eine Aminogruppe besitzen, sind sie in Säuren und Basen löslich. In basischem Milieu können 2- und 4-Aminophenol von starken Oxidationsmitteln reversibel zu den entsprechenden Chinoniminen umgesetzt werden (vgl. Indophenol, siehe auch Chinone).
Darstellung
4-Aminophenol wird durch elektrolytische Reduktion von 4-Nitrophenol in stark schwefelsaurer Lösung hergestellt.[10]
Verwendung
Der Farbstoff Indophenol lässt sich durch oxidative Kupplung von 4-Aminophenol mit Phenol in alkalischer Lösung mit Natriumhypochlorit als Oxidationsmittel herstellen. Die Aminophenole dienen auch zur Darstellung zahlreicher Azofarbstoffe.
Momme Andresen entdeckte 1888, dass 4-Aminophenol als Entwickler für die Schwarzweißfotografie eingesetzt werden kann. Es ist unter dem Handelsnamen Rodinal bekannt.[10]
Aus 4-Aminophenol leiten sich u. a. Phenacetin und Paracetamol ab. Sie dienen beide als Arzneistoffe zur Schmerzbehandlung und Fiebersenkung.

Bei der Polykondensation von Aminophenolen mit Formaldehyd erhält man Kunstharze, die als Anionenaustauscher Bedeutung erlangt haben.
Risikobewertung
4-Aminophenol wurde 2020 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von 4-Aminophenol waren die Besorgnisse bezüglich anderer gefahrenbezogener Bedenken sowie der vermuteten Gefahren durch mutationsauslösende und sensibilisierende Eigenschaften. Die Neubewertung fand ab 2020 statt und wurde von Italien durchgeführt. Anschließend wurde ein Abschlussbericht veröffentlicht.[11][12]
Weblinks
- www.chemieunterricht.de: Bunte Farben aus weißen Pulvern.
Einzelnachweise
- ↑ Eintrag zu M-AMINOPHENOL in der CosIng-Datenbank der EU-Kommission, abgerufen am 19. Januar 2022.
- ↑ Eintrag zu Aminophenol, Isomere in der GESTIS-Stoffdatenbank des IFA, abgerufen am 11. August 2016. (JavaScript erforderlich)
- ↑ a b c d e f g Eintrag zu 2-Aminophenol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 28. Januar 2024. (JavaScript erforderlich)
- ↑ a b c d e f g Eintrag zu 3-Aminophenol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. Januar 2025. (JavaScript erforderlich)
- ↑ a b c d e f g Eintrag zu 4-Aminophenol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 28. Januar 2024. (JavaScript erforderlich)
- ↑ a b c d e f W. M. Haynes (Hrsg.): CRC Handbook of Chemistry and Physics. 97. Auflage. (Internet-Version: 2016), CRC Press / Taylor and Francis, Boca Raton FL, Dissociation Constants of Organic Acids and Bases, S. 5-89.
- ↑ Eintrag zu 2-aminophenol in der Datenbank ECHA CHEM der Europäischen Chemikalienagentur (ECHA), abgerufen am 11. August 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Eintrag zu 3-aminophenol in der Datenbank ECHA CHEM der Europäischen Chemikalienagentur (ECHA), abgerufen am 11. August 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Eintrag zu 4-aminophenol in der Datenbank ECHA CHEM der Europäischen Chemikalienagentur (ECHA), abgerufen am 11. August 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ a b Beyer/Walter: Lehrbuch der Organischen Chemie, 19. Auflage, S. Hirzel Verlag, Stuttgart 1981, ISBN 3-7776-0356-2, S. 527.
- ↑ Europäische Chemikalienagentur (ECHA): Substance Evaluation Conclusion and Evaluation Report.
- ↑ Community Rolling Action Plan (CoRAP) der Europäischen Chemikalienagentur (ECHA): 4-aminophenol, abgerufen am 6. März 2022.
Auf dieser Seite verwendete Medien
Globales Harmonisiertes System zur Einstufung und Kennzeichnung von Chemikalien (GHS) Piktogramm für gesundheitsgefährdende Stoffe.
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances
Struktur von o-Aminophenol
Struktur von m-Aminophenol
Struktur von p-Aminophenol
Autor/Urheber: Michał Sobkowski, Lizenz: CC BY-SA 3.0
Synthesis of paracetamol