Säureamide
Säureamide sind eine chemische Stoffgruppe. Formal betrachtet handelt es sich bei den Säureamiden um Kondensationsprodukte von Oxosäuren mit Ammoniak oder Aminen, wobei die größte Bedeutung Carbonsäureamide und Sulfonsäureamide haben.[1]
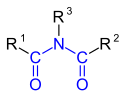
| Allgemeine Struktur von Säureamiden (Beispiele): | |
|---|---|
 | 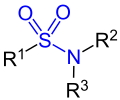 |
| Carbonsäureamide | Sulfonsäureamide |
| R1=Alkyl-, Arylgruppe, R2, R3=Alkyl-, Arylgruppe, Wasserstoff | |
Säureamide
Einfache Säureamide
Die einfachsten Vertreter der Säureamide sind Amidosulfonsäure und Sulfuryldiamid als Mono- und Diamid der Schwefelsäure, Nitrylamid als Amid der Salpetersäure, die Carbamidsäure und Harnstoff als Mono- und Diamid der Kohlensäure, sowie Phosphoramidsäure,[S 1] Phosphordiamidsäure[S 2] und Phosphorsäuretriamid[S 3] als Mono-, Di- und Triamid der Phosphorsäure.[2] Während der Harnstoff zu den organischen Verbindungen gezählt wird, sind die anderen Vertreter dieser einfachen Säureamide anorganische Verbindungen.
Carbonsäureamide
Die wichtigste und umfangreichste Untergruppe der Säureamide sind die Carbonsäureamide die durch Umsetzung von Carbonsäuren oder Carbonsäurederivaten wie Carbonsäureestern und Carbonsäurechloriden mit Ammoniak oder Aminen hergestellt werden. Verbindungen mit mehreren Carbonsäureamidgruppen werden als Polyamide bezeichnet.[3] Natürlich vorkommende sind die Peptide und Proteine.
Cyclische Verbindungen mit einer Amidgruppe im Ring werden als Lactame bezeichnet.
Carbonsäureamide die eine zweite Acylgruppe am Stickstoffatom aufweisen gehören zur Stoffgruppe der Imide.
Sulfonsäureamide
Sulfonsäureamide leiten sich von Sulfonsäuren ab, bei denen eine Hydroxygruppe durch eine Aminogruppe ersetzt ist. Die bedeutsamsten Sulfonsäureamide sind die Sulfonamide – Benzolsulfonsäureamide, die in ‘‘para‘‘-Stellung eine Aminogruppe enthalten. Diese Verbindungen besitzen eine bakteriostatische Wirkung. Durch Substitution eines der beiden Amid-Wasserstoffatome des einfachsten Vertreters Sulfanilamid durch einen organischen Rest, leiten sich alle pharmakologisch wirksamen Sulfonamide ab.[4]
Weblinks
Einzelnachweise
- ↑ Eintrag zu Amide. In: Römpp Online. Georg Thieme Verlag, abgerufen am 10. Mai 2023.
- ↑ Eintrag zu Phosphoramide. In: Römpp Online. Georg Thieme Verlag, abgerufen am 13. Juni 2023.
- ↑ M. D. Lechner, K. Gehrke, E. H. Nordmeier: Makromolekulare Chemie. Ein Lehrbuch für Chemiker, Physiker, Materialwissenschaftler und Verfahrenstechniker. 4. Auflage, Birkhäuser, Basel / Boston, Mass. / Berlin 2010, ISBN 978-3-7643-8890-4, S. 121–125.
- ↑ Bernd Schmidt, Jolanda Hermanns: Grundlagen der organischen Chemie. Begründet von Joachim Buddrus. 6. Auflage. De Gruyter, Berlin, Boston 2022, ISBN 978-3-11-070087-9, S. 538.
Externe Links zu erwähnten Verbindungen
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Phosphoramidsäure: CAS-Nr.: 2817-45-0, PubChem: 65107, ChemSpider: 58617, Wikidata: Q27098293.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Phosphordiamidsäure: CAS-Nr.: 10043-91-1, EG-Nr.: 233-145-5, ECHA-InfoCard: 100.030.119, PubChem: 165802, ChemSpider: 145304, Wikidata: Q27276706.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Phosphorsäuretriamid: CAS-Nr.: 13597-72-3, PubChem: 123317, ChemSpider: 109920, Wikidata: Q22693530.
Auf dieser Seite verwendete Medien
Chemical diagram showing lactams of increasing ring size (left to right: beta-lactam, gamma-lactam, delta-lactam, and epsilon-lactam)
Autor/Urheber: Jü, Lizenz: CC0
Tert-Sulfonicacid_Amide_Structure
general chemical structure of Carboxamides
Autor/Urheber: Jü, Lizenz: CC0
Markierte Peptidbindungen in einem Tetrapeptid