Aldosteron
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Aldosteron | |||||||||||||||||||||
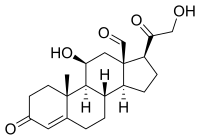
| Andere Namen | 11β,21-Dihydroxy-3,20-dioxopregn-4-en-18-al | |||||||||||||||||||||
| Summenformel | C21H28O5 | |||||||||||||||||||||
| Kurzbeschreibung | weißer Feststoff[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | H02AA01 | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 360,44 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand | fest | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Aldosteron ist ein natürliches Steroidhormon, das aus Cholesterin gebildet wird und zu den Mineralocorticoiden zählt; da die Produktion in der Nebennierenrinde stattfindet, ist es auch ein Corticosteroid. Aldosteron wirkt insbesondere in der Niere, wo es die Ausscheidung von Natrium hemmt und die Ausscheidung von Kalium steigert; durch die Erhöhung des Natriumbestands steigert es das Blutvolumen und damit den Blutdruck. Der synthetische Aldosteronabkömmling Fludrocortison wird als Arzneistoff eingesetzt; größere Bedeutung haben jedoch die Antagonisten des Aldosterons, die zu den kaliumsparenden Diuretika zählen und beispielsweise bei Herzinsuffizienz verschrieben werden.
Bildung
Aus Cholesterin wird über die Zwischenstufe Pregnenolon durch Oxidation am C3-Atom das Progesteron gebildet. Durch weitere Hydroxylierungen an Positionen 21β, 18β und 11β wird 18-Hydroxycorticosteron gebildet. In einer sich anschließenden Oxidation der Hydroxygruppe am C18-Atom entsteht daraus das Aldosteron.
 Reaktionsweg für die Synthese von Aldosteron ausgehend von Pregnenolon.
Reaktionsweg für die Synthese von Aldosteron ausgehend von Pregnenolon.
Aldosteron wird in der Zona glomerulosa – der äußersten Schicht der Nebennierenrinde – produziert. Die Aldosteronausschüttung steigt durch eine Verminderung von Blutvolumen und Blutdruck (vermittelt über Angiotensin II über AT1-Rezeptoren) und eine Hyperkaliämie (zu hohe Kaliumkonzentration im Blut). Die Natriumkonzentration im Blut beeinflusst die Aldosteronsynthese gegensinnig: steigt das Natrium im Blut, wird die Biosynthese gehemmt; sinkt das Natrium, ist sie stimuliert. ACTH stimuliert die Aldosteron-Synthese, während atriales natriuretisches Peptid (ANP) die Ausschüttung hemmt. Die Biosynthese von Mineralcorticoiden wird noch durch Substanzen mit beta-adrenerger Wirkung angeregt und durch Dopamin gehemmt.
Funktion und Regulation
In Verbindungstubuli und Sammelrohren der Niere bewirkt Aldosteron über die Aktivierung von Mineralokortikoidrezeptoren (MR) einen vermehrten Einbau von Natriumkanälen (ENaC) in die luminale Membran und Natriumtransportern (Na+/K+-ATPase) in die Plasmamembran zum Interstitium. Dadurch wird der Transport von Natrium über das Epithel erleichtert, was eine vermehrte Wasserrückresorption zur Folge hat. Gleichzeitig kommt es zu einer erhöhten Ausscheidung von Kalium- und Ammoniumionen sowie Protonen. Insgesamt bewirkt Aldosteron einen Anstieg des Extrazellulärvolumens, eine Abnahme der Kaliumkonzentration und einen Anstieg des pH-Wertes im Blut.
Seine Wirksamkeit kann durch Aldosteron-Antagonisten wie Spironolacton, Canrenoat und Eplerenon gehemmt werden.
Die Wirksamkeit von Aldosteron auf den Mineralhaushalt ist etwa 1000-mal höher als die von Cortisol, weil das Cortisol in den aldosteronsensitiven Zellen der Niere durch die 11β-Hydroxysteroiddehydrogenase Typ 2 zu Cortison umgewandelt wird und den Rezeptor nicht aktivieren kann. Die Rezeptoraffinität ist gleich.
Aldosteron wird durch das Renin-Angiotensin-Aldosteron-System reguliert. Weiterhin kann der Anstieg der Kaliumkonzentration die Synthese von Aldosteron aktivieren.
Eine wichtige Rolle des Aldosterons und des Renin-Angiotensin-Aldosteron-Systems ist die Blutdruckregulation. Zudem scheint Aldosteron in der Bewältigung von lebensbedrohlichen Stresssituationen erforderlich zu sein.
Pathophysiologie
Kurzfristige innerhalb von Minuten oder Stunden eintretende Wirkungen von Aldosteron dienen der Aufrechterhaltung des Flüssigkeits-, Elektrolyt- und Säure-Basen-Haushaltes (Milieu intérieur) durch Steigerung der Rückresorption von Natrium sowie vermehrte Ausscheidung von Kalium und Protonen (physiologische Effekte).
Chronisch über Tage, Wochen und Monate erhöhte Aldosteron-Spiegel haben dagegen ungünstige Effekte. Es kommt zu einem Kalium-Mangel (Hypokaliämie), zu einem Anstieg des pH-Werts (Alkalose), zum Bluthochdruck und zu einer vermehrten Bildung von Bindegewebe (Fibrose) in Herz und Nieren, was letztendlich zu chronischem Herz- und Nierenversagen führen kann (pathophysiologische Effekte).[2]
Normalwerte
Der Normalwert im Blutplasma liegt bei 20–150 ng/l. Der Aldosteronspiegel ist erniedrigt bei Nebennierenrindeninsuffizienz und Schock. Der Aldosteronspiegel ist erhöht bei Stress, nach Operationen und bei erhöhter Angiotensin-II-Aktivität (Hyperaldosteronismus).
Krankheiten
Der primäre Hyperaldosteronismus (ein Conn-Syndrom) ist selten, ein sekundärer Hyperaldosteronismus findet sich hingegen häufiger bei Herzinsuffizienz und bei Leberzirrhose. Ungünstige Effekte von Aldosteron wurden auch bei akutem Herzinfarkt, nephrotischem Syndrom, therapierefraktärem Bluthochdruck, chronischem Nierenversagen, insbesondere bei diabetischer Nephropathie, und metabolischem Syndrom beschrieben.[3]
Ein Mangel von Aldosteron kann beispielsweise im Rahmen einer Autoimmunerkrankung (Morbus Addison), einem Adrenogenitalen Syndrom (AGS) oder bei einer Tuberkulose der Nebennieren auftreten.
Siehe auch
Weblinks
- Wolfgang Pumberger: Aldosteron – Physiologie, Biosynthese und ihre Störungen. Beitrag in der Themenbibliothek der Medizinischen Universität Wien
Einzelnachweise
- ↑ a b c Datenblatt Aldosterone bei Sigma-Aldrich, abgerufen am 20. März 2011 (PDF).
- ↑ Andrew S Brem: The Janus effect: two faces of aldosterone. In: Kidney International. 75, Nr. 2, Januar 2009, S. 137–139. doi:10.1038/ki.2008.567. PMID 19116642.
- ↑ Robert W. Schrier et al.: Aldosterone: role in edematous disorders, hypertension, chronic renal failure, and metabolic syndrome. In: Clinical Journal of the American Society of Nephrology. 5, Nr. 6, Juni 2010, S. 1132–1140. doi:10.2215/CJN.01410210. PMID 20448074.
Auf dieser Seite verwendete Medien
Skeletal formula of aldosterone. Created using ACD/ChemSketch 10.0, Inkscape, and vim.
Autor/Urheber: Achim Lother, Freiburg, Lizenz: CC BY-SA 3.0
Mechanismus der Mineralokortikoidrezeptor-abhängigen Rückresorption von Natrium und Wasser im Epithel der Sammelrohre. MR, Mineralokortikoidrezeptor; HRE, "hormone response element"; ENaC, (Amilorid-sensitiver) epithelialer Natriumkanal; Sgk1, Serum-Glukokortikoid-regulierte Kinase 1; Chif, Kortikosteroid-induzierter Faktor; ki-Ras, Kirsten Ras GTP-bindendes Protein-2A
Aldosteronsynthese, ausgehend von Progenolon




