Akkumulator


Ein Akkumulator (kurz Akku), auch Sekundärbatterie genannt, ist ein wiederaufladbares galvanisches Element, bestehend aus zwei Elektroden und einem Elektrolyten, das elektrische Energie auf elektrochemischer Basis speichert.
Ein einzelnes wiederaufladbares Speicherelement wird Sekundärelement oder Sekundärzelle genannt, im Gegensatz zur nicht (oder nur sehr begrenzt) wiederaufladbaren Primärzelle. Der Ladevorgang basiert auf der elektrolytischen Umkehrung der bei der Entladung ablaufenden chemischen Reaktionen durch Anlegen einer elektrischen Spannung.
Sekundärzellen lassen sich – wie Primärzellen – zu Batterien zusammenschalten, in Reihenschaltung (für höhere elektrische Spannung) oder in Parallelschaltung (für höhere Kapazität oder höhere Stromstärken). Beide Schaltungsvarianten führen zur entsprechenden Erhöhung des Gesamt-Energiegehalts [Produkt aus Kapazität und Spannung, angegeben in Wattstunden (Wh)] der Anordnung.
Bei jedem Akkumulatortyp ist die Nennspannung der Akkumulatorzelle durch die verwendeten Materialien festgelegt; da jene für die meisten Anwendungen zu gering ist, wird häufig die Reihenschaltung angewandt, um die Spannung zu erhöhen (siehe Bild Starterbatterie). Die Kapazität und die mögliche Stromstärke hängen dagegen von der Baugröße ab. Deshalb ist eine Parallelschaltung mehrerer Zellen in der Regel nicht nötig; stattdessen verwendet man einen Akku mit entsprechend groß dimensionierten Zellen.
Begriffsklärung
Akkumulator

Das lateinische Wort accumulator bedeutet ‚Sammler‘ (cumulus ‚Haufen‘, accumulare ‚anhäufen‘). Bleiakkumulatoren wurden früher dementsprechend auch Bleisammler genannt.[1] Ursprünglich war mit Akkumulator ein einzelnes wiederaufladbares Speicherelement gemeint (Sekundärzelle). Heute bezeichnet der Begriff – zumindest in der Allgemeinsprache – auch wiederaufladbare Speicher, die aus zusammengeschalteten Sekundärzellen bestehen. Wenn es auf den Unterschied ankommt, sollte man genauere Bezeichnungen verwenden:
- einzelnes Speicherelement: Sekundärzelle, Sekundärelement, Akkumulatorzelle, Akkuzelle
- zusammengeschaltete Speicherelemente: Z. B. Akkupack, Batterie aus Sekundärzellen
Batterie
Eine Batterie ist eine Kombination mehrerer gleichartiger technischer Teile. Hier handelt es sich im engeren Sinn um elektrisch und mechanisch miteinander verbundene galvanische Zellen bzw. Elemente.[2] Es gibt Batterien aus Primärzellen (nicht wiederaufladbar) und solche aus Sekundärzellen (wiederaufladbar). Ursprünglich waren mit Batterien nur solche aus Primärzellen gemeint.
In der Umgangssprache dient Batterie als Oberbegriff für einzelne oder zusammengeschaltete Primärzellen und Sekundärzellen.
Beide Zellentypen sind in gleichen Baugrößen auf dem Markt, und beide werden im Englischen battery genannt. Akkuzellen heißen im Englischen rechargeable batteries (dt. „wiederaufladbare Batterien“) oder accumulators.
Elektrische Verbraucher, die mit Primär- oder Sekundärzellen betrieben werden, nennt man oft einfach batteriebetrieben (Batteriebetrieb). Wenn im täglichen Umgang mit dem Gerät die Wiederaufladbarkeit eine Rolle spielt, spricht man vom Akkubetrieb.
Kondensator
Kondensatoren und auch Elektrolytkondensatoren sind ebenfalls Speicher für elektrische Energie, allerdings speichern sie diese nicht in chemischer Form, sondern als elektrisches Feld zwischen ihren Platten. Sie und auch die chemisch ähnlicheren Doppelschichtkondensatoren sind keine Akkumulatoren und werden auch nicht so bezeichnet.
Geschichte
Die erste Vorform eines Akkumulators, der – im Gegensatz zu den Zellen von Alessandro Volta – nach der Entladung wiederaufladbar war, wurde 1803 von Johann Wilhelm Ritter gebaut. Den bekanntesten Akkutyp, den Bleiakkumulator, konstruierte 1854 der Mediziner und Physiker Wilhelm Josef Sinsteden. 1859 entwickelte Gaston Planté Sinstedens Erfindung durch eine spiralförmige Anordnung der Bleiplatten erheblich weiter. Um die Wende zum 20. Jahrhundert speisten von Holz umfasste Bleiakkumulatoren in Glasgefäßen Elektroantriebe für Automobile. Die Akkutechnik nahm in der Zeit eine rasante Entwicklung. Folgender vom Telegraphentechnischen Reichsamt 1924 veröffentlichter Text zeigt das am Beispiel der damals etablierten Telegrafie und der noch jungen Telefonie. Akkumulatoren werden hier „Sammler“ genannt, und „Batterien“ waren Ansammlungen galvanischer Elemente:
„[1899] waren für den Telegraphen wie für den Fernsprecher nasse und trockene Elemente die hauptsächlichen Stromquellen. Für den Telegraphen wurden Batterien vorwiegend aus Zink-Kupfer-Elementen verwendet; im Fernsprechdienst waren daneben hauptsächlich nasse Zink-Kohle- und Trockenelemente in Benutzung. Als leistungsfähigere Stromquellen wurden nach 1900 Sammler, die vereinzelt schon seit dem Jahre 1895 zum Betriebe der Mikrophone bei den größten Fernsprechämtern verwendet worden waren, in größerem Umfang eingeführt. […] Zur Ladung der 12 zelligen Batterie stellte man beim Amt Dynamomaschinen auf, die mit einer eigenen Kraftanlage (meist Leicht- oder Schwerölmotoren) ausgerüstet waren oder aus dem örtlichen Starkstromnetz angetrieben wurden und den erforderlichen Gleichstrom in passender Stromstärke und Spannung lieferten. Es wurde anfangs allgemein im wechselnden Lade- und Entladebetrieb gearbeitet, d. h. abwechselnd speiste die eine Batterie das Amt, während die andere geladen wurde. Später (1921) ging man dazu über, den Strom für das Amt unmittelbar Dynamomaschinen zu entnehmen, deren elektrische Eigenschaften diesem Zwecke besonders angepaßt werden mußten, und ihnen eine ‚Puffer‘-Batterie parallel zu schalten.“[3]
Technik
Funktionsweise
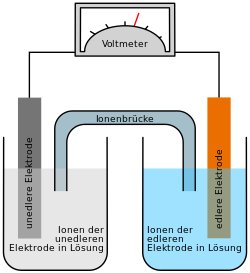
In einem Akkumulator wird beim Aufladen elektrische Energie in chemische Energie umgewandelt. Wird ein Verbraucher angeschlossen, so wird die chemische Energie wieder zurück in elektrische Energie umgewandelt (siehe dazu: Galvanische Zelle). Die für eine elektrochemische Zelle typische elektrische Nennspannung, der Wirkungsgrad und die Energiedichte hängen von der Art der verwendeten Materialien ab.
Akkumulatortypen
Die Akkumulatortypen[4] werden nach den verwendeten Materialien bezeichnet.
Auflistung nach Materialien
| Material | Abk. | Spannung | Bemerkungen |
|---|---|---|---|
| Alkali-Mangan-Zelle | RAM | 1,5 V | wird zunehmend vom Nickel-Zink-Akkumulator verdrängt |
| Aluminium-Akkumulator | experimenteller Prototyp[5] | ||
| Bleiakkumulator | Pb | 2 V | |
| Calcium-Ionen-Akkumulator | Ca-Ion | 1,8 V | in Entwicklung[6][7] |
| Lithium-Ionen-Akkumulatoren | Li-Ion | 3,2–3,7 V | Oberbegriff für verschiedene Lithium-Ionen-Akkumulatortypen |
| Lithium-Cobaltdioxid-Akkumulator | LiCoO2 | 3,6 V | erste verfügbare Technologie |
| Lithium-Polymer-Akkumulator | LiPo | 3,7 V | Bauform mit Polymer als Elektrolyt |
| Lithium-Mangan-Akkumulator | Li-Mn | 3,6 V | |
| Lithium-Nickel-Cobalt-Mangan-Akkumulator | Li(NiCoMn)O2 | 3,6–3,7 V | |
| Lithium-Eisenphosphat-Akkumulator | LiFePO4 | 3,3 V | häufiger Einsatz in Elektroautos |
| Lithium-Eisen-Yttrium-Phosphat-Akkumulator | LiFeYPO4 | Yttrium-Dotierung zur Verbesserung der Eigenschaften[8] | |
| Lithiumtitanat-Akkumulator | LiTi | 2,4 V | |
| Lithium-Akkumulatoren mit metallischem Lithium | sie zählen nicht zu der größeren und bekannteren Gruppe der Ionen-Akkumulatoren | ||
| Lithium-Luft-Akkumulator | seit den 1970ern in Entwicklung | ||
| Lithium-Schwefel-Akkumulator | seit den 1960ern in Entwicklung | ||
| Natrium-Nickelchlorid-Zelle | NaNiCl | 2,58 V | Markenbezeichnung: ZEBRA-Batterie |
| Natrium-Ionen-Akkumulator | Na-Ion | 1,6–1,7 V | |
| Natrium-Schwefel-Akkumulator | NaS | 2 V | Hochtemperatur-Akku |
| Nickel-Cadmium-Akkumulator | NiCd | 1,2 V | Verkaufsverbot in der EU |
| Nickel-Eisen-Akkumulator | NiFe | 1,2–1,9 V | |
| Nickel-Lithium-Akkumulator | NiLi | 3,47 V | |
| Nickel-Metallhydrid-Akkumulator | NiMH | 1,2 V | |
| Nickel-Wasserstoff-Akkumulator | NiH2 | 1,5 V | |
| Nickel-Zink-Akkumulator | NiZn | 1,65 V | |
| Polysulfid-Bromid-Akkumulator | |||
| Silber-Zink-Akkumulator | 1,5 V | ||
| Silizium-Luft-Akkumulator | in Entwicklung[9][10][11] | ||
| Vanadium-Redox-Akkumulator | 1,41 V | bei 25 °C | |
| Zink-Brom-Akkumulator | 1,76 V | ||
| Zink-Luft-Akkumulator | in Entwicklung[12][13] | ||
| Zinn-Schwefel-Lithium-Akkumulator | experimenteller Prototyp[14] |
Energiedichte und Wirkungsgrad


Für viele Anwendungen, insbesondere für mobile Geräte im Bereich der Unterhaltungselektronik, Hörgeräte oder auch Fahrzeuge, ist die Energiedichte von Bedeutung. Je höher diese ist, desto mehr Energie kann in einem Akku je Volumen- bzw. Masseneinheit gespeichert werden. Die auf die Masse bezogene Energiedichte wird oft auch als spezifische Energie bezeichnet. Bezogen auf marktübliche Typen, haben Akkumulatoren (Sekundärzellen) meist eine (oftmals deutlich) geringere Energiedichte als Primärzellen.
Oft sind Akkus mit besonders hoher Energiedichte überproportional teuer oder haben andere Nachteile, insbesondere eine beschränkte Lebensdauer. So kosten Bleiakkumulatoren typischerweise 100 €/kWh; Li-Ion-Akkus hingegen derzeit (2012) typischerweise 350 €/kWh (200 €/kWh 2013), Tendenz fallend.[15][16] Ursachen sind die anlaufende Massenproduktion, welche die Stückkosten durch bessere Technik und Skaleneffekte deutlich verringern. Allerdings werden die sinkenden Produktionskosten nur verzögert an die Kunden weitergegeben, da auf diesem Markt, speziell in Deutschland, durch die wenigen Angebote nur ein geringer Preisdruck besteht.
Beim Aufladen und Entladen von Akkumulatoren wird durch den inneren Widerstand der Zellen Wärme freigesetzt, wodurch ein Teil der zum Aufladen aufgewandten Energie verloren geht. Das Verhältnis der entnehmbaren zu der beim Laden aufzuwendenden Energie wird als Ladewirkungsgrad bezeichnet. Generell sinkt der Ladewirkungsgrad sowohl durch Schnellladung mit sehr hohen Strömen als auch durch schnelle Entladung (Peukert-Effekt), da die Verluste am Innenwiderstand zunehmen. Das optimale Nutzungsfenster ist dabei je nach Zellchemie stark unterschiedlich.
Auflistung nach Energiedichte
| Energiedichte (Wh/kg) | Akkumulatortyp | Ladewirkungsgrad[17] (Stand 2007) | Besonderheit |
|---|---|---|---|
| 1100 | Zinn-Schwefel-Lithium-Akkumulator | Experimenteller Prototyp[14] | |
| 1060[5] | Aluminium-Akkumulator | schnellladefähig, experimentelle Prototypen | |
| 900 | Nickel-Lithium-Akkumulator | ||
| 350 | Lithium-Schwefel-Akkumulator | 90 %[18] | Labor-Prototyp[19] |
| 140–260[20] | Lithium-Polymer-Akkumulator | 90 % | praktisch beliebige Bauform möglich |
| 150–220 | Lithium-Nickel-Cobalt-Mangan-Akkumulator | 95 % | hohe Kapazität |
| 140–210 | Lithium-Eisenphosphat-Akkumulator | 94 % | schnellladefähig, hochstromfähig, eigensicher |
| 120–220 | Natrium-Schwefel-Akkumulator | 70–85 % | 300 °C Betriebstemperatur, keine Selbstentladung, aber Heizverluste 15–30 % |
| 120–210 | Lithium-Cobaltdioxid-Akkumulator | 90 % | neuere Modelle schnellladefähig[21] |
| 160 | Natrium-Ionen-Akkumulator | ||
| 65–210 | Silber-Zink-Akkumulator | 83 % | teuer, kurzlebig, empfindlich, sehr hohe Kapazität |
| 100–120 | Natrium-Nickelchlorid-Akkumulator | 80–90 % | 300 °C Betriebstemperatur, keine Selbstentladung, aber Heizverluste 10–20 % |
| 60–110 | Nickel-Metallhydrid-Akkumulator | 70 % | |
| 70–90 | Lithiumtitanat-Akkumulator | 90–95 % | schnellladefähig |
| 60 | Nickel-Wasserstoff-Akkumulator | 75 % | |
| 40–60 | Nickel-Cadmium-Akkumulator | 70 % | EU-weit verboten, mit Ausnahme von Notsystemen und dem medizinischen Bereich |
| 50 | Nickel-Zink-Akkumulator | 65 % | |
| 40 | Nickel-Eisen-Akkumulator | 65–70 % | sehr unempfindlich gegen Über- und Tiefentladung |
| 30 | Bleiakkumulator | 60–70 % |
Im Zuge der stetigen Weiterentwicklung werden von Jahr zu Jahr höhere Energiedichten möglich. So erreichten viele Antriebsbatterien mit Produktionsstart 2019 etwa die doppelte Energiedichte wie die im Jahr 2010.[22] Im Jahr 2023 erreichten Prototypen von Lithium-Ionen-Akkumulatoren eine Energiedichte von 700 W⋅h⋅kg−1, während praktisch eingesetzte Zellen etwa 300 W⋅h⋅kg−1 erreichen.[23]
Ein Vergleich zur Speicherung elektrischer Energie zeigt die Vor- und Nachteile von Akkus gegenüber anderen Speicherverfahren.
Ladungsmenge (Kapazität)

Die Ladungsmenge, die ein Akkumulator speichern kann, wird in Amperestunden (Ah) angegeben und als Kapazität (Nennkapazität) bezeichnet. Diese darf nicht verwechselt werden mit der Kapazität eines Kondensators, die als von der Spannung abhängige Ladungsmenge definiert ist und in Farad (F) angegeben wird. Die angegebene Nennkapazität beim Akku bezieht sich immer auf einen bestimmten Entladestrom und nimmt – je nach Akkutyp – unterschiedlich stark mit höheren Entladeströmen ab.
Bei Primärzellen und Akkumulatoren ist die Angabe der Nennkapazität in Amperestunden (Ah), bei kleineren Einheiten auch Milliamperestunden üblich. Der Vorsatz für Maßeinheiten Milli steht für ein Tausendstel. Dabei sagt die Angabe, ein Akkumulator liefert zum Beispiel 1000 Milliamperestunden, also eine Amperestunde nicht viel über die Leistungsfähigkeit des Akkus aus, wenn die Spannung nicht bekannt ist. Die Spannung ist stark von der Belastung der Zelle abhängig, da sie einen inneren Widerstand hat. Ihre maximale Leistung gibt sie theoretisch bei halber Nennspannung ab. Dann sind innerer und Lastwiderstand gleich groß und der Entladewirkungsgrad erreicht 50 Prozent. Da sich die Zelle dabei stark erwärmt, sind derart hohe Belastungen nur kurzzeitig möglich. Ein Beispiel hierfür sind Starterbatterien von Autos, die beim Anlassen für ein paar Sekunden einige hundert Ampere abgeben. Einige Zellentypen können nicht so hoch belastet werden und haben Schutzschaltungen, die das verhindern.
Angaben in Wh oder kWh (oft bei Antriebsbatterien zu finden) beziehen sich immer auf ein bestimmtes Lastprofil. Um die Leistungsfähigkeit von Akkus zu vergleichen, muss man also wissen, welches Lastprofil bei der Messung der Kapazität verwendet wurde.
Ladezustand

Ein wichtiger Kennwert von mit Sekundärbatterien betriebenen Geräten ist der Ladezustand von Akkumulatoren (englisch state of charge, SOC). Er wird üblicherweise in Prozentwerten angegeben, wobei 100 % einen vollständig geladenen Akkumulator repräsentieren. 100 % minus den Wert des Ladezustands ergibt den Entladungsgrad (englisch depth of discharge, DOD).[24]
Zur Bestimmung sind verschiedene Methoden gebräuchlich: chemische, spannungsabhängige, Strom-integrative (Ladungsbilanzierung) und druckabhängige Verfahren sowie die Messung der Akkumulator-Impedanz.[25]
Selbstentladung – empfohlene Lagerung
Wird ein Akku nicht verwendet, so verliert er über die Zeit einen Teil seiner gespeicherten Energie. Diesen Vorgang nennt man Selbstentladung. Das Maß der Selbstentladung hängt von Typ und Alter des Akkumulators sowie von der Lagertemperatur ab.
Für die Lagerung von Akkus wird meistens Folgendes empfohlen: (Hinweis: Der Ladezustand ist relativ gesehen zur Entladeschlussspannung. Das heißt, wenn ein Akku einen Ladezustand von 0 % aufweist, dann ist damit gemeint, dass er seine Entladeschlussspannung erreicht hat; bei NiCd- und NiMH-Akkus liegt diese z. B. bei 0,9 V bzw. 1,0 V.)
- Li-Ion: Ladezustand 60 %, 20 °C; Selbstentladung monatlich < 2 %
- Bleiakkumulator: Ladezustand 100 %, möglichst kühl lagern; Selbstentladung monatlich 5–10 % (Blei-Säure) bzw. 2–5 % (Blei-Gel), ein über längere Zeit entladener Akku ist zerstört
- NiMH: Ladezustand 40 %; Selbstentladung monatlich um 15–25 %, neuere Typen als NiMH-Akkumulator mit geringer Selbstentladung mit nur etwa 15 % im Jahr
- NiCd: Ladezustand 40 %; Selbstentladung monatlich um 10 %
- Alkali-Mangan RAM-Zellen: Ladezustand 100 %; Zellspannung sollte nicht unter 1,2 V sinken
Sanyo hat 2005 (Markteinführung in Europa August 2006) einen modifizierten NiMH-Akku namens Eneloop auf den Markt gebracht, der einer Selbstentladung von lediglich 15 % pro Jahr unterliegt. Es handelt sich hierbei um sogenannte LSD-Akkus (low self discharge), die aufgrund ihrer geringen Selbstentladung als bereits vorgeladene Akkus verkauft werden können und daher im Gegensatz zu herkömmlichen Akkus vor der ersten Benutzung durch den Käufer nicht aufgeladen werden müssen.
Alle Angaben zur Selbstentladung beziehen sich auf eine Raumtemperatur von ca. 20 °C.
Lebensdauer und Zyklenfestigkeit
Lithium-Eisenphosphat-Akkumulatoren erreichen nach Herstellerangaben mehr als 5000 Zyklen bei jeweiliger Entladetiefe von 80 %, nach 7000 Zyklen noch 70 %.[26] Als weltgrößter Hersteller von Lithium-Eisenphosphat-Akkumulatoren gilt BYD,[27] der durch präzise Fertigung eine große Auswahl an Zellen für zyklenfeste Anwendungen, wie zum Beispiel im Einsatz bei stationären Speichersystemen entwickelt hat. Nach 6000 Zyklen Laufleistung mit 100 % Be- und Entladung bei einer Rate von 1 C (Laderate, C-Faktor) haben diese noch eine Restkapazität von mindestens 80 %. Das entspricht bei einem Vollzyklus pro Tag einer Lebensdauer von mind. 20 Jahren.[28]
Der Lithium-Eisenphosphat-Akkumulator Sony Fortelion hat nach 10.000 Zyklen mit 100 % Entladungsgrad noch eine Restkapazität von 71 %. Dieser Akkumulator ist seit 2009 auf dem Markt.[29]
In Batteriespeichern eingesetzte Lithium-Ionen-Akkumulatoren weisen teilweise eine Zyklenfestigkeit von mehr als 10.000 Lade- und Entladezyklen und eine lange Standzeiten von theoretisch berechneten 20 Jahren auf.[30][31]
Varta Storage gibt auf seine Produktfamilie Engion Family und engion home eine Garantie von 14.000 Vollzyklen und einer Lebensdauer von 10 Jahren.[32][33]
Die Lebensdauer von stationären Batterien bei konstanter Raumtemperatur von 10–25 °C kann bei Traktionsbatterien nur durch Thermomanagement erreicht werden. Ungleiche Temperaturschwankungen der Zellen innerhalb der Antriebsbatterie führen zu Kapazitätsunterschieden und zu unterschiedlicher Alterung der Zellen. Die verfügbare Kapazität eines Lithium-Akkus sinkt mit fallender Betriebstemperatur, besonders unterhalb der 25 °C Betriebstemperatur, bei der die Nennkapazität bestimmt wird, und sollte den Gefrierpunkt des Elektrolyten wegen Eisbildung nicht unterschreiten. Andererseits altert eine Zelle umso schneller, je höher die Betriebstemperatur ist, mit stark steigender Tendenz oberhalb von ca. 40 °C.[34] Ziel des Thermomanagements ist, dass zur selben Zeit alle Zellen im Volumen die gleiche Temperatur haben, die eine möglichst hohe Leistung bei geringer Alterung bereitstellt.
Weiterhin beeinflusst das BMS wesentlich die Kapazität der in Reihe geschalteten Zellen, die beim passiven Balancieren durch die schwächste Zelle bestimmt wird. In der Folge wird sowohl die Gesamtkapazität verringert als auch die schwächste Zelle am meisten beansprucht, wodurch diese am schnellsten altert. Demgegenüber kann das aufwändige aktive Balancieren einen Ladungsausgleich von den Zellen hoher Kapazität zu denen geringer Kapazität durchführen und die Lebensdauer und die Kapazität aller Zellen auch einer nicht mehr homogenen, älteren Batterie verfügbar halten. Die Hersteller gewähren entsprechend ihrer Technik stark unterschiedliche Garantien auf die Laufleistung von Antriebsbatterien.
Nach Studien aus dem Jahr 2024 sind Akkus von Elektroautos auch bei einer Laufleistung von 300.000 km meist noch voll alltagstauglich. Daher spricht nichts gegen den Kauf von gebrauchten Elektroautos. Nach Studien verlieren die Akkus von Elektroautos pro Jahr etwa 1,8 Prozent ihrer Kapazität, wodurch Laufzeiten von mehr als 15 Jahren möglich sind. Im Vergleich beträgt in Deutschland die durchschnittliche Lebensdauer von Verbrennern 12 Jahre. Nach Studien liegt die Kapazität der Akkus nach 100.000 km bei über 90 Prozent und verschlechtert sich danach kaum noch. Durch neuere Zellchemie werden diese Werte ständig verbessert. Jedoch kann häufiges Schnellladen und starkes Beschleunigen die Werte der Akkus verschlechtern. Ebenso sollten lange Standzeiten mit vollem Akku und Tiefentladungen vermieden werden.[35]
Ladezeiten
Die Ladezeit eines Akkus bzw. einer Batterie aus Akkumulatorzellen ist abhängig von verschiedenen Faktoren. Dazu zählen Parameter wie der Innenwiderstand, der direkten Einfluss auf den Ladestrom hat und wiederum von der Temperatur beeinflusst wird. Kürzere Ladezeiten bedeuten höhere Strombelastung und höheren Verschleiß, stehen also im Zielkonflikt zur Lebensdauer des Akkumulators. Je nach Anwendung, Zellchemie und technischer Umsetzung (Klimatisierung, Überwachung) sind daher die praktisch erreichbaren Ladezeiten sehr unterschiedlich.
Laderate
Der vom Hersteller empfohlene bzw. zulässige Ladestrom wird dabei über die Laderate C beschrieben und ist u. a. auch abhängig vom Ladezustand. Die Ladespannung ist durch die Zellchemie und den Batterieaufbau bestimmt. Aus diesen beiden Parametern ergibt sich eine obere Grenze der maximalen Ladeleistung, die zugunsten einer höheren Lebensdauer oft noch reduziert wird. Die praktisch erreichbaren Ladezeiten sind daher meist höher als die technisch möglichen Ladezeiten. Als äußere Faktoren sind neben der Temperatur die zur Verfügung stehende Spannungs- und Stromquelle und das angewendete Ladeverfahren zu nennen. Die Akkuzellhersteller geben die einzuhaltenden Parameter und Nutzungsfenster in ihren Datenblättern vor, die von den Herstellern der Endprodukte beachtet werden müssen.
Für klassische Akkus, wie Blei, NiCd und NiMH sind Laderaten bei Normalladung von 0,1 C bis 0,2 C üblich. Das entspricht Ladezeiten von 5–10 Stunden. Bei modernen Lithiumakkus ist in den Datenblättern der Hersteller meist mit 0,5 C die Normalladung spezifiziert, was 2 Stunden Ladedauer entspricht. Zusätzlich wird ein maximal erlaubter, höherer Ladestrom angegeben, beispielsweise 3 C, was eine Aufladung in 20 Minuten ermöglichen würde.[36] Praktisch sind Ladezeiten von 20 Minuten bis 4 Stunden im Mobilgerätebereich üblich.[37][38][39] Elektroautos wie Tesla Model S, Renault Zoe, BMW i3, Nissan Leaf usw. können ihre Akkus an derzeitigen (2017) Schnellladestationen innerhalb von etwa 30 Minuten zu 80 Prozent aufladen.[40][41][42][43][44] Beim Elektroauto Li Mega kann der Akku in 10 Minuten von 10 auf 80 Prozent aufgeladen werden. Die Laderate beträgt dort 5C (Stand 2024). Heutige Lithium-Akkus können oft auch deutlich schneller geladen werden. Im Modellbaubereich sind Ladezeiten von 10 bis 15 Minuten bei Schnellladung üblich. Die Obergrenze der Ladeleistung wird gerade bei größeren Batterien von Elektrofahrzeugen in der Praxis nicht mehr von den Akkumulatorzellen, sondern vom Aufbau der Traktionsbatterie (Klimatisierung) und von der verfügbaren Ladetechnik bestimmt. So können neue Schnellladesysteme Elektroautos mit entsprechend konstruierten Traktionsbatterien innerhalb von etwa 15 min zu 80 Prozent aufladen (siehe z. B. Hyundai Ioniq 5).[45][46][47][48]
Akkuforschung
Forscher der Justus-Liebig-Universität Gießen haben zusammen mit Wissenschaftlern der BASF SE eine neue reversibel arbeitende Zelle auf Basis von Natrium und Sauerstoff entwickelt. Als Reaktionsprodukt tritt hierbei Natriumsuperoxid auf.[49]
Wissenschaftler der Universität Oslo aus Norwegen haben einen Akkumulator entwickelt, der unterhalb einer Sekunde wieder aufgeladen werden kann. Nach Meinung der Wissenschaftler wäre dieser Akkumulator interessant u. a. für Stadtbusse, die so an jeder Haltestelle geladen werden könnten und somit nur eine relativ kleine Batterie benötigen würden. Ein Nachteil ist, so die Forscher, dass je größer die Batterie ist, desto größer muss auch der Ladestrom sein. Somit kann der Akku nicht sehr groß sein. Nach Angaben der Forscher könnte der neuartige Akku auch als Puffer in Sportwagen eingesetzt werden, um kurzfristig Leistung bereitzustellen. Vorerst denken die Forscher aber an Einsatzbereiche in Klein- und Kleinstgeräten.[50][51]
In Laboratorien des Unternehmens StoreDot aus Israel können Berichten zufolge erste Labormuster von nicht näher spezifizierten Akkus in Mobiltelefonen (Akkukapazität im Bereich um 1 Ah) mit Stand April 2014 in 30 Sekunden geladen werden.[52][53] Das gleiche Unternehmen entwickelte auch einen Akkumulator für E-Autos, der in 5 Minuten voll aufgeladen ist und dann 160 Kilometer Reichweite bietet. Er besitzt anstatt einer üblichen Graphitelektrode eine Elektrode aus Germaniumnanopartikeln, langfristig soll dafür aber Silizium verwendet werden. Der Akku soll schon industriell gefertigt werden können, aber es gibt noch keine geeigneten Ladesäulen.[54]
Forscher aus Singapur haben 2014 einen Akku entwickelt, der nach 2 Minuten zu 70 Prozent aufgeladen werden kann. Die Akkus setzen auf die Lithium-Ionen-Technik. Jedoch besteht die Anode, der negative Pol in der Batterie, nicht mehr aus Graphit, sondern einem Titandioxid-Gel. Das Gel beschleunigt die chemische Reaktion deutlich und sorgt so für ein schnelleres Aufladen. Insbesondere sollen diese Akkus in Elektroautos verwendet werden.[55][56][57] Bereits im Jahr 2012 haben Forscher der Ludwig-Maximilian-Universität in München das Grundprinzip entdeckt.[58]
Festkörperakkumulatoren sind eine spezielle Bauform, bei welchem beide Elektroden und auch der Elektrolyt aus verschiedenen, festen Materialien bestehen. Da keine Flüssigkeiten vorhanden sind, gibt es kein Problem mit Undichtigkeiten, sollte der Akkumulator beschädigt werden.
An der Universität Linköping ist es Forschern gelungen, einen Akkumulator aus organischen Materialien herzustellen. Diese basieren auf Redox-Flow-Batterien und enthalten als Elektroden den Kunststoff PEDOT, der dotiert wurde, und als Elektrolyt eine Lösung aus Wasser und Chinonen. Der Akku ist vollständig recycelbar und sehr billig, allerdings hat er immer noch eine geringere Energiedichte als vergleichbare Redox-Flow-Batterien mit dem teuren Metall Vanadium.[59]
Wissenschaftler der Stanford-Universität in Kalifornien haben einen neuartigen Akku mit sehr günstigen Eigenschaften entwickelt. Bei dem Aluminium-Ionen-Akkumulator besteht die Anode aus Aluminium und die Kathode aus Grafit. Der Akku schafft mehr als 7500 Ladezyklen ohne Qualitätseinbußen. Die zur Fertigung des Akkus notwendigen Materialien sind sehr kostengünstig und zudem sehr leicht. Der Akku kann nicht in Brand geraten, selbst wenn man ihn durchbohrt. Die Dauer des Ladevorgangs beträgt eine Minute. Zudem ist der Akku biegsam und kann somit in eine gewünschte Form gebogen und gefaltet werden. Der Akku ist noch nicht marktreif, da die Spannung und die Energiedichte noch zu gering sind.[60][61]
Nach Schätzungen werden bis 2025 bzw. spätestens 2030 die Lithium-Schwefel- wie auch die Lithium-Luft-Akkutechnologie im Automobilbereich einsetzbar sein. Beide haben eine höhere Energiedichte als die im Jahr 2015 eingesetzte Lithium-Ionen-Technologie und versprechen höhere Reichweiten in der Elektromobilität.[62][63]
In Deutschland unterstützt das BMBF seit 2013 die Forschung an einem Magnesium-Luft-Akkumulator, der ohne Lithium auskommt.[64] Solche Akkumulatoren haben eine hohe Kapazität und der Rohstoff ist in ausreichenden Mengen vorhanden, doch ist die Lebensdauer bislang gering.[65]
Ein Team, angeführt von Yan Yu, an der Chinesische Universität für Wissenschaft und Technik in Hefei hat einen Akku entwickelt, der eine hohe Kapazität und Spannung aufweist, auch wenn er 2.000 Mal ge- und entladen wurde (96 % Kapazität blieben erhalten). Er basiert auf Tri-Natrium-Di-Vanadium-Triphosphat (Na3V2(PO4)3) im Innern eines Graphenemischmaterials.[66] Wissenschaftler am japanischen Nagoya Institute of Technology untersuchten ebenfalls Natrium als Akkumaterial und identifizierten die Natrium-Vanadium-Verbindung Na2V3O7 als geeignetes Kathodenmaterial.[67] Wegen niedriger Energiedichte wird dabei zunächst an einen stationären Einsatz gedacht.
Preisentwicklung

Bleiakkumulatoren kosteten 2014 typischerweise 355 €/kWh.[69] Die Preise für Li-Ion-Akkus sind in den letzten Jahren deutlich gefallen: 2007 lagen die Kosten noch bei mehr als 1000 US-Dollar/kWh, 2014 noch bei 300 Dollar/kWh, 2019 bei 156 Dollar/kWh,[70] Tendenz weiter fallend.[71] So gab z. B. die Chefin von General Motors, Mary Barra 2016 bekannt, dass die Akkukosten des Chevrolet Bolt bei ca. 145 Dollar/kWh liegen würden, für 2022 rechnete sie mit Akkukosten von 100 Dollar/kWh.[72][73] Eric Feunteun, Leiter der Sparte Elektromobile bei Renault, teilte im Juli 2017 mit, dass Renault pro kWh Akku 80 Dollar bezahle.[74][75] Auch die Marktpreise für Li-Ion-Akkus einschließlich Gewinnmarge sollen bis 2030 unter 100 $/kWh sinken.[76]
Für 2015 gab das Energieministerium der Vereinigten Staaten die Kosten von Lithium-Ionen-Akkumulatoren für Elektroautos mit ca. 250 $/kWh an; angestrebt wurde ein Wert von 125 $/kWh im Jahr 2022.[68] Ursachen für den Preisrückgang sind die zunehmende Massenproduktion, welche die Stückkosten durch bessere Technologien und Skaleneffekte verringert.
Nach einer Studie von McKinsey sind die Akkupreise zwischen 2010 und 2016 um 80 Prozent gefallen.[77]
Für 2021 wurden mittlere Kosten für Batteriezellen von 121 US$/kW angegeben.[78] Allerdings sind zahlreiche Rohmaterialien im Laufe des Jahres 2021 deutlich teurer geworden. Die Kosten eines kompletten Speichersystems sind durch zusätzliche Kosten u. a. für Einkapselung, Kühlung, Stromanschlüsse, Steuerung und ggf. Umrichter wesentlich höher.
An der Pennsylvania State University wurde ein Lithium-Eisenphosphat-Akkumulator entwickelt, der ohne das seltene Kobalt auskommt und daher günstiger zu produzieren sein sollte.[79]
Bloomberg New Energy hatte im Juli 2024 eine Studie veröffentlicht, nach der die Preise für Lithium-Eisen-Phosphat-Akkumulatoren in China innerhalb der letzten 12 Monate um 51 Prozent auf 53 USD pro kWh gefallen waren. Ein Jahr davor lag der Preis noch bei 95 USD pro kWh. Dadurch seien nun 2/3 der Elektroautos in China, dem weltweit größten Automarkt, günstiger als vergleichbare Autos mit Verbrennungsmotor. Es würde noch etwas dauern, bis diese Preise außerhalb von China angekommen seien.[80]
Herstellungsländer
2022 befanden sich 77 % der Herstellkapazitäten für Lithium-Ionen-Akkumulatoren von 1163 GWh jährlich in China, gefolgt von je 6 % in Polen und den USA.[81] Sechs der zehn größten Hersteller im Jahr 2022 hatten ihren Hauptsitz in China.
Verwendung
Einsatzgebiete

Akkumulatoren werden oft verwendet, wenn ein elektrisches oder elektronisches Gerät oder Fahrzeug ohne dauerhafte Verbindung zum festen Stromnetz oder zu einem Generator betrieben werden soll. Da sie teurer sind als nicht wiederaufladbare Primärbatterien, kommen sie vor allem in solchen Geräten zum Einsatz, die regelmäßig benutzt werden und einen nicht vernachlässigbaren Strombedarf haben, wie Mobiltelefone, Laptops oder Akkuwerkzeuge.
In Fahrzeugen mit Verbrennungsmotor dient ein Akku in Form der Starterbatterie dazu, Strom für Licht, Bordelektronik und vor allem den Anlasser zum Starten des Verbrennungsmotors zu liefern. Läuft der Motor, wird der Akkumulator über den als Lichtmaschine bezeichneten Generator wieder aufgeladen. Ähnliches gilt für Schiffe und Flugzeuge.
Fahrzeuge mit batterieelektrischem Antrieb beziehen die Energie zum Fahren aus Akkuzellen, diese werden in ihrer Gesamtheit zur Unterscheidung von Starterbatterien als Antriebsbatterie bezeichnet. Auch Schiffe und Flugzeuge gibt es mit batterieelektrischem Antrieb.
Akkus kommen auch in Form von Batteriespeichern zum Einsatz, um Schwankungen bei der regenerativen Erzeugung von Strom mit Wind und/oder Sonne auszugleichen. Batterie-Speicherkraftwerke werden u. a. eingesetzt zur Abdeckung von Spitzenlasten im Stromnetz und auch zur Netzstabilisierung in Stromnetzen. Möglich ist auch der Betrieb als Inselanlage in einem Inselnetz, wenn sich eine abgelegene Verbrauchsstelle nicht oder nur zu unverhältnismäßig hohen Kosten an das Stromnetz anschließen lässt. Oft sind solche Verbrauchsstellen zusätzlich noch mit einem Notstromaggregat ausgerüstet, das einspringt, bevor die Ladung der Akkus z. B. nach mehrtägiger Windstille nicht mehr ausreicht. Beispiele für solche Installationen sind nicht nur abgelegene Hütten, Mobilfunk-Basisstationen in wenig erschlossenen Regionen oder Weltraumsatelliten, sondern auch viele Parkscheinautomaten, bei denen ein Anschluss an das Stromnetz teurer wäre als die Installation einer Solarzelle und eines Akkumulators. Akkuspeicher werden von Besitzern von privaten Solaranlagen genutzt, um den selbst erzeugten Strom zu anderen Zeiten nutzen zu können, und damit v. a. Preisunterschiede, Abgaben und Umlagen gegenüber einer Netzeinspeisung mit Bezug aus dem Netz zu anderen Zeiten zu vermeiden.
Konventionelle U-Boot-Antriebe bestehen aus Dieselmotoren mit Generatoren (Fahren und Laden der Akkumulatoren bei nicht getauchter Fahrt/Schnorcheln) und mit Akkumulatoren betriebenen Elektromotoren (Tauchfahrten).
Akkumulatoren dienen in Systemen zur unterbrechungsfreien Stromversorgung (USV) auch zur kurz- bis mittelfristigen Überbrückung von Ausfällen der stationären Energieversorgung. Wichtige Bereiche, die es mit einer Notstromversorgung abzusichern gilt, sind z. B. Rechenzentren, Alarmsysteme und lebenserhaltende Systeme in Krankenhäusern. Werden hohe Leistungen benötigt oder sind längere Zeiträume zu überbrücken, wird noch ein Dieselgenerator zusätzlich installiert; die Akkus übernehmen dann die Versorgung nur so lange, wie der Dieselgenerator zum Anspringen und Erreichen der Nenndrehzahl benötigt. Falls die so zu überbrückende Zeit nur kurz ist, können dafür auch andere Systeme als Akkumulatoren eingesetzt werden, insbesondere auf der Basis von Schwungmassen oder gar Kondensatoren.
Auswahlkriterien
Kriterien für die Auswahl eines Akkumulatortyps für eine bestimmte Anwendung sind unter anderem:
- Die gravimetrische Energiedichte, auch als spezifische Energie bezeichnet. Sie sagt aus, wie viel elektrische Energie ein Akkumulator pro Masseneinheit (zum Beispiel Kilogramm) liefern kann. Dieser Wert ist besonders interessant für elektrisch angetriebene Fahrzeuge. Herkömmliche Bleiakkumulatoren erreichen hier rund 30 Wh/kg, Lithium-Ionen-Akkus (Li-Ion-Akkus) bis zu 140 Wh/kg.
- Die volumetrische Energiedichte. Sie sagt aus, wie viel Wh elektrischer Energie ein Akkumulator pro Volumen (zum Beispiel pro Liter Rauminhalt) liefern kann. Hier liegt der Wert für herkömmliche Bleiakkumulatoren bei ca. 50 Wh/l, bei Li-Ion-Akkus etwa 500 Wh/l.
- Der maximal mögliche Entladestrom. Er ist wichtig für alle Anwendungen, bei denen kurzzeitig sehr hoher Leistungsbedarf besteht. Dieses ist zum Beispiel beim Starten von Fahrzeugmotoren der Fall, aber auch bei Elektrowerkzeugen und Autofokus-Kameras, insbesondere solchen mit integrierten Blitzgeräten.
- Die möglichen Dimensionen (Abmessungen und Gewicht) und Bauformen der Akkuzelle. Sie sind entscheidend, wenn der Akkumulator auf möglichst kleinem Raum in elektronischen Geräten integriert werden soll. Ein gasdichter Aufbau etwa eines Gel-Bleiakkumulators ermöglicht den lageunabhängigen Einsatz ohne Gefahr durch auslaufenden Elektrolyt oder korrosive Gase
- Der Memory-Effekt bei NiCd oder Batterieträgheitseffekt bei NiMH tritt abhängig vom Lade- und Entladeverfahren auf und führt unter Umständen zu erheblichen Verringerungen der Kapazität (NiCd) oder der Spannung (NiMH). In Anwendungen, bei denen der Akkumulator nicht regelmäßig vollständig entladen und wieder voll aufgeladen wird, sollten deshalb Akku-Arten verwendet werden, die für diese Effekte nicht anfällig sind, zum Beispiel Blei-Akkus oder Li-Ion-Akkus.
Aus der Anwendung der oben genannten Kriterien ergeben sich für jeden Akkutyp einige typische Anwendungsgebiete, wobei insbesondere bei NiCd-, NiMH- und Li-Ion-Akkus die Übergänge fließend sind:
- Bleiakkumulator: Starter-Batterien für Fahrzeuge mit Verbrennungsmotoren, Antriebsbatterien für Flurfördergeräte, Stationärbetrieb in Notbeleuchtungsanlagen
- NiCd-Akku: Elektrowerkzeuge, Antriebe im Modellbau, portable elektronische Geräte mit kurzzeitig hoher Stromaufnahme (Foto-Blitzgeräte)
- NiMH-Akku: portable elektronische Geräte mit konstanter Stromaufnahme, Modellbau
- Li-Ion-Akku: portable elektronische Geräte mit kleinen Abmessungen und langer Betriebszeit (Mobiltelefone, Notebooks, Kameras), Antriebsbatterien für Elektroautos
- Li-Po-Akku (auch Lipo, Lithium-Polymer): Antriebe im Modellbau, Mobiltelefon, Antriebsbatterie für extreme Reichweiten, Bsp.: Kruspan-Hotzenblitz[82]
- Li-Mn-Akku: Antriebe im Modellbau, neue Profiklasse von Elektrowerkzeugen, Pedelecs, Fahrzeugakku für hohe Reichweiten
- Li-Fe-Akku: Antriebe im Modellbau, neue Profiklasse von Elektrowerkzeugen, Antriebsbatterien für Elektroautos
- Lithium-(Nano)-Titanat-Akku: Antrieb von Elektrokraftwagen mit großen Reichweiten
Weiterentwicklung
Als Weiterentwicklung der herkömmlichen Akkumulatoren werden Brennstoffzellen-Systeme verwendet, die elektrische Energie ohne exotherme Verbrennung aus chemischer Energie in Wasserstoff oder Methanol umwandeln und diesen Prozess teilweise auch umkehren können (Reversible Brennstoffzelle). Da die Brennzelle selbst keine Energie speichern kann, muss deshalb immer zusätzlich auch ein Speichersystem verwendet werden, dessen Raumbedarf und Gewicht zu berücksichtigen sind. Dabei erfordern die Speichermedien Wasserstoff, Methanol und ähnliche Gase bzw. leichtflüchtige Flüssigkeiten andere technische Anforderungen als Akkumulatoren.
Die Begriffe elektrochemische Zelle und Redox-Flow-Zelle sind parallel entstanden.
Konkurrierende Energiespeicher sind Hydraulikspeicher, bei denen die Energie mechanisch gespeichert wird.
Brandgefahr
Akkus können durch Überhitzung Brände auslösen, es gibt immer wieder Berichte brennender E-Autos.[83] Im Januar 2025 hat eine Powerbank in Südkorea einen Brand in einem Airbus verursacht und diesen zerstört.[84][85][86] Die Regeln wurden daraufhin verschärft.[87]
Entsorgung
Das Batteriegesetz besagt, dass Batterien und Akkumulatoren nicht in den Hausmüll geworfen werden dürfen.[88] Mit der Zeit wird die Außenhülle einer Batterie oder eines Akkumulators durch Korrosion zersetzt, sodass umweltschädliche und giftige Chemikalien auslaufen. Passiert dies auf einer Mülldeponie, gelangen die giftigen Schadstoffe in das Ökosystem, die Schadstoffe der Batterie versickern in das Grundwasser und können so möglicherweise ins Trinkwasser gelangen oder Pflanzen schaden. Damit dies nicht geschehen kann, müssen Batterien und Akkus zum Sondermüll gegeben werden, wo sie umweltgerecht entsorgt werden.
Literatur
- Fritz Paul Beck, Karl-Joachim Euler: Elektrochemische Energiespeicher. 2 Bände. 1984.
- Edmund Hoppe: Die Akkumulatoren für Elektricität. Julius Springer, Berlin 1892.
- Thomas B. Reddy (Hrsg.): Linden’s Handbook of Batteries. 4. Auflage. McGraw-Hill, New York 2011, ISBN 978-0-07-162421-3.
- Lucien F. Trueb, Paul Rüetschi: Batterien und Akkumulatoren. Mobile Energiequellen für heute und morgen. Springer, Berlin 1998, ISBN 3-540-62997-1.
- Martin Winter, Jürgen O. Besenhard: Wiederaufladbare Batterien. Teil 1: Akkumulatoren mit wäßriger Elektrolytlösung. In: Chemie in unserer Zeit, 1999, 33, Nr. 5, S. 252–266; doi:10.1002/ciuz.19990330503 oder chemie.uni-mainz.de (PDF).
- Martin Winter, Jürgen O. Besenhard: Wiederaufladbare Batterien. Teil 2: Akkumulatoren mit nichtwäßriger Elektrolytlösung. In: Chemie in unserer Zeit, 1999, 33, Nr. 6, S. 320–332; doi:10.1002/ciuz.19990330603 oder chemie.uni-mainz.de (PDF).
- DIN 40 729 Akkumulatoren – Galvanische Sekundärelemente – Grundbegriffe.
- Franz Bendt: Der Accumulator. In: Die Gartenlaube. Heft 6, 1895, S. 90–94 (Volltext [Wikisource]).
- Bekanntmachung, betreffend die Einrichtung und den Betrieb von Anlagen zur Herstellung elektrischer Akkumulatoren aus Blei oder Bleiverbindungen. 11. Mai 1898. In: Deutsches Reichsgesetzblatt, 1898, Nr. 19, S. 176–180. Volltext (Wikisource)
Weblinks
- Literatur von und über Akkumulator im Katalog der Deutschen Nationalbibliothek
- Ratgeber Batterien und Akkus. (PDF 3,7 MB) Umweltbundesamt.
Einzelnachweise
- ↑ W. Bermbach: Die Vorgänge im ruhenden Bleisammler. In: Die Akkumulatoren. Springer Berlin Heidelberg, Berlin, Heidelberg 1929, ISBN 978-3-662-27628-0, S. 65–75, doi:10.1007/978-3-662-29115-3_4 (springer.com [abgerufen am 17. Mai 2025]).
- ↑ Ernst Grimsehl u. a.: Lehrbuch der Physik. Band II, Teubner, Leipzig 1954, S. 38.
- ↑ Telegraphentechnisches Reichsamt: Das deutsche Telegraphen-, Fernsprech- und Funkwesen 1899–1924. S. 29.
- ↑ Dirk Uwe Sauer:Optionen zur Speicherung elektrischer Energie in Energieversorgungssystemen mit regenerativer Stromerzeugung. ( vom 24. September 2015 im Internet Archive) (PDF; 1,1 MB) ISEA (RWTH Aachen)
- ↑ a b Aluminum-Ion Battery to Transform 21st Century Energy Storage. (PDF) Oak Ridge National Laboratory, archiviert vom (nicht mehr online verfügbar) am 19. November 2015; abgerufen am 30. Oktober 2014.
- ↑ CARBAT - Calcium Rechargeable Battery Technology. Abgerufen am 27. November 2023.
- ↑ Alternative zu Lithium-Akkus: Forschern gelingt Durchbruch bei Kalzium-Batterien. Abgerufen am 17. Mai 2025.
- ↑ Winston Battery Company Overview. ( vom 27. Januar 2012 im Internet Archive) winston-battery.com; abgerufen am 12. Februar 2012.
- ↑ Stromspeicher aus Sand und Luft. 5. Oktober 2012, archiviert vom ; abgerufen am 17. Mai 2025.
- ↑ E-Autos: Neue Akkus sollen den Durchbruch bringen - WiWo Green. 2. März 2013, archiviert vom ; abgerufen am 17. Mai 2025.
- ↑ Jetzt läuft Sie ( vom 20. Dezember 2017 im Internet Archive), 2. Dezember 2017.
- ↑ Zink-Luft-Akkus fürs Netz. Archiviert vom (nicht mehr online verfügbar) am 19. Oktober 2018; abgerufen am 12. Juni 2019.
- ↑ Peter Glösekötter: Projekt Zink-Luft-Akkumulator. Hrsg.: FH-Münster.
- ↑ a b Researchers Develop Novel High-Performance Polymer Tin Sulfur Lithium Ion Battery. Abgerufen am 17. Mai 2025.
- ↑ M. Seiwert, R. Böhmer, J. Rees, F. W. Rother:E-Auto-Batterien: Daimler und Evonik suchen Partner für Li-Tec. ( vom 5. Februar 2016 im Internet Archive) Wiwo.de, 15. Juni 2013. Darin Audi-Chef Rupert Stadler: „Vor drei Jahren lagen die Preise pro Kilowattstunde noch bei 500 Euro … jetzt sind es rund 200 Euro. Und ich gehe davon aus, dass das nicht das Ende ist.“
- ↑ Batterien für Elektroautos werden laut Tesla Motors immer günstiger - Mein Elektroauto. 24. Februar 2012, abgerufen am 17. Mai 2025.
- ↑ Alles über Akkus (Informationen über Akkus und Batterien und Ladetechnik/Lagegeräte). funkcom.ch, Matthias Frehner
- ↑ Lithium-Schwefel-Technik: So übertrumpft sie heutige Akkus - WELT. Abgerufen am 17. Mai 2025.
- ↑ Sion Introduces a Lithium Sulfur Rechargeable Battery ( vom 18. Juni 2009 im Internet Archive) evworld.com; abgerufen am 8. Februar 2011.
- ↑ High Energy Batteries for use in mobile electronics, rc modeling or solar racing ( vom 3. November 2013 im Internet Archive), Herstellerangaben; abgerufen am 2. November 2013.
- ↑ Der Super-Akku. Abgerufen am 17. Mai 2025.
- ↑ Hendrik Löbberding, Saskia Wessel, Christian Offermanns, Mario Kehrer, Johannes Rother, Heiner Heimes, Achim Kampker: From Cell to Battery System in BEVs: Analysis of System Packing Efficiency and Cell Types. In: World Electric Vehicle Journal. Band 11, Nr. 4, Dezember 2020, ISSN 2032-6653, S. 77, doi:10.3390/wevj11040077 (mdpi.com [abgerufen am 25. September 2023]).
- ↑ Quan Li, Yang Yang, Xiqian Yu, Hong Li: A 700 Wh kg<sup>-1</sup> rechargeable pouch type lithium battery. In: Chinese Physics Letters. 2023, ISSN 0256-307X, doi:10.1088/0256-307x/40/4/048201 (iop.org).
- ↑ Konrad Reif: Batterien, Bordnetze und Vernetzung. Springer, 2010, ISBN 978-3-8348-9713-8, S. 26 (Google Books).
- ↑ Dietrich Naunin: Hybrid-, Batterie- und Brennstoffzellen-Elektrofahrzeuge Technik, Strukturen und Entwicklungen. Expert Verlag, 2007, ISBN 978-3-8169-2625-2, S. 57 (Google Books).
- ↑ Spezifikation WB-LYP100AHA Zelltyp ( vom 27. August 2017 im Internet Archive), Herstellerangaben von Winston Battery; abgerufen am 31. Mai 2019.
- ↑ Lithium-Eisenphosphat-Akkumulator. Abgerufen am 17. Mai 2025.
- ↑ Simon Landenberger: BYD Battery-Box wird 6 Jahre alt. In: FENECON GmbH. 26. April 2021, abgerufen am 17. Mai 2025.
- ↑ Sony Fortelion. ( vom 6. Juni 2014 im Internet Archive; PDF) frankensolar.de, S. 13; abgerufen am 3. Juni 2014.
- ↑ Photovoltaik-Speichersystem von Bosch überzeugt durch sehr hohe Zyklenfestigkeit; Lithium-Ionen-Batterien absolvieren Alterungstest erfolgreich ( vom 30. März 2014 im Internet Archive) „Die Tests setzten die Batterien extremen Belastungen aus. So wurden über einen Zeitraum von 5 Jahren bei einer Entladungstiefe von 60 % mehr als 10.000 äquivalente Vollzyklen erreicht.“ und „Simulationen, die sich auf unsere Laborergebnisse und die unserer Kollegen vom ZSW stützen, zeigen, dass bei Berücksichtigung beider Alterungsprozesse die Batterien im BPT-S 5 Hybrid bis zu 20 Jahre betriebsfähig sind“; abgerufen am 29. März 2014.
- ↑ „Die Zellen haben laut Hersteller eine voraussichtliche Lebensdauer von 20 Jahren und könnten bis zu 15.000 Mal aufgeladen werden“ ( vom 9. Juni 2014 im Internet Archive), solarserver.de; abgerufen am 29. März 2014.
- ↑ BitSign GmbH: VARTA Storage garantiert 14.000 Zyklen bei Batteriespeichern. Abgerufen am 17. Mai 2025.
- ↑ VARTA Storage erweitert Garantie für Batteriespeicher auf 14.000 Zyklen. ( vom 13. Juli 2015 im Internet Archive) abgerufen am 13. Juli 2015.
- ↑ Entwicklung eines modularen Batterie Management Systems für Lithium-Polymer-Akkumulatoren. ( vom 29. Oktober 2018 im Internet Archive) (PDF) esa.informatik.tu-darmstadt.de; abgerufen am 4. Juni 2019
- ↑ Martin Sambale: Wie lange die Batterie von E-Autos hält. In: augsburger-allgemeine.de. 9. Januar 2025, abgerufen am 11. Januar 2025.
- ↑ Datenblatt WB-LYP100AH. ( vom 7. Juni 2013 im Internet Archive) Winston Battery; abgerufen am 22. August 2017.
- ↑ Das OnePlus 3 ist offiziell. Zitat: Ist die Batterie mal leer, geht es laut Hersteller in 30 Minuten von null auf 60 Prozent. Abgerufen am 15. Juni 2016.
- ↑ phonearena.com OnePlus 3’s Dash charging solution is fast and cool: 63% of battery juice in 30 minutes, 14. June 2016.
- ↑ Fabian von Thun: Beste Schnellladefunktion: Diese Handys laden am schnellsten. In: chip.de. Abgerufen am 11. Juni 2024.
- ↑ Golem.de: IT-News für Profis. Abgerufen am 17. Mai 2025.
- ↑ Hanne Lübbehüsen: Elektroauto: Tesla errichtet Gratis-Schnellladestationen. In: Die Zeit. 24. Oktober 2013, ISSN 0044-2070 (zeit.de [abgerufen am 17. Mai 2025]).
- ↑ Das erste vernünftige E-Auto im Test. Abgerufen am 17. Mai 2025.
- ↑ Golem.de: IT-News für Profis. Abgerufen am 17. Mai 2025.
- ↑ byd-auto.net ( vom 6. Februar 2016 im Internet Archive) Webseite von BYD: 40(min) / 15(min 80%).
- ↑ 400. Abgerufen am 17. Mai 2025 (englisch).
- ↑ Standardisierung von Hochvolt-Ladesystemen: HPC. Abgerufen am 17. Mai 2025.
- ↑ heise Autos: Europäischer 350 kW-Ladesäulen-Korridor. Archiviert vom am 20. August 2023; abgerufen am 17. Mai 2025 (deutsch).
- ↑ Elon Musk: Tesla Supercharger V3 mit über 350 kW - electrive.net. 3. Januar 2017, abgerufen am 17. Mai 2025.
- ↑ Pascal Hartmann, Conrad L. Bender, Milos Vračar, Anna Katharina Dürr, Arnd Garsuch, Jürgen Janek, Philipp Adelhelm: A rechargeable room-temperature sodium superoxide (NaO2) battery. In: Nature Materials. 2012, doi:10.1038/nmat3486.
- ↑ Ridiculously-Fast-Charging Batteries (Not Supercapacitors) Developed In Norway. ( vom 6. Mai 2016 im Internet Archive) In: cleantechnica.com.
- ↑ Marius Valle: De har lagt grunnlaget for batterier som kan lades 1000 ganger raskere. 28. April 2016, abgerufen am 17. Mai 2025 (norwegisch).
- ↑ Smartphone - Alle Produkte und Testberichte. Abgerufen am 17. Mai 2025.
- ↑ 'Günstiger' Quantenpunkt-Akku lädt in 30 Sekunden. 7. April 2014, abgerufen am 17. Mai 2025.
- ↑ Erstmals E-Auto-Batterien produziert, die in fünf Minuten aufladen. In: Frankfurter Neue Presse. 9. Juli 2021, abgerufen am 18. Oktober 2021.
- ↑ Eine neue Art von Akku erreicht schon nach zwei Minuten am Strom eine 70-prozentige Ladung. Vor allem Elektroautos sollen profitieren. ( vom 20. Oktober 2014 im Internet Archive) bluewin.ch; abgerufen am 30. Dezember 2014.
- ↑ Ultra-fast charging batteries that can be 70% recharged in just two minutes. Abgerufen am 17. Mai 2025 (englisch).
- ↑ Golem.de: IT-News für Profis. Abgerufen am 17. Mai 2025.
- ↑ Joachim Kroll: Lithium-Titan lädt in Sekunden. Abgerufen am 17. Mai 2025 (deutsch).
- ↑ LiU researchers first to develop an organic battery. In: chemeurope.com. 20. Oktober 2020, abgerufen am 18. Oktober 2021.
- ↑ Thomas Langenbucher: Forscher: Aluminium-Speicher "hat alles, was man sich für eine Batterie erträumen kann". In: ecomento.de. 13. April 2015, abgerufen am 17. Mai 2025.
- ↑ Meng-Chang Lin u. a.: An ultrafast rechargeable aluminium-ion battery. In: Nature. Band 520, 2015, S. 324–328, doi:10.1038/nature14340.
- ↑ Kai Stoppel: Zäher Fortschritt in der Forschung. Traum vom Super-Akku droht zu platzen. Interview mit Dirk Uwe Sauer, Leiter des Instituts für Stromrichtertechnik und Elektrische Antriebe an der RWTH Aachen. n-tv.de, 31. August 2015, abgerufen am 29. November 2015.
- ↑ StromAir (Alias): DE setzt auf Akkus mit Lithium-Schwefel / Lithium-Luft. Zusammenfassung des Vortrags von Dr. Patrick Plötz vom Competence Center Energietechnologien und Energiesysteme, Fraunhofer-Institut für System- und Innovationsforschung ISI am 31.08.2015 auf dem 2. Swiss eSalon in Bern zum Thema Batterieperspektive. tff-forum.de, 31. August 2015, abgerufen am 29. November 2015.
- ↑ Metall-Luft-Batterie. ( vom 1. November 2019 im Internet Archive) Förderinitiative Energiespeicher, 18. Oktober 2016
- ↑ Magnesium-Luft-Batterien versprechen vierfache Reichweite für Elektroautos. Neuartige Akku-Technologie. In: ingenieur.de. VDI Verlag, 4. Januar 2019, abgerufen am 27. November 2019.
- ↑ C. Zhu, P. Kopold, P. A. van Aken, J. Maier, Y. Yu: High Power–High Energy Sodium Battery Based on Threefold Interpenetrating Network. In: Adv. Mater. 28, 2016, S. 2409–2416. doi:10.1002/adma.20150594.
- ↑ Japanische Forscher wollen Natrium als Alternative zu Lithium aufbauen. Perfekte Natriumverbindung errechnet. In: ingenieur.de. VDI Verlag, 12. Februar 2019, abgerufen am 27. November 2019.
- ↑ a b Paul Donohoo-Vallett u. a.: Revolution Now… The Future Arrives for Five Clean Energy Technologies – 2016 Update (PDF) Energieministerium der Vereinigten Staaten. Abgerufen am 6. November 2016.
- ↑ Ingo Stadler: Energiespeicher – Bedarf, Technologien, Integration. Springer Vieweg, Berlin 2014, ISBN 978-3-642-37379-4.
- ↑ - Sascha Mattke: Akkus: Auf dem Weg zu 100 Dollar pro Kilowattstunde. In: heise.de. 20. Dezember 2019, abgerufen am 14. November 2020.
- ↑ Lithium-Ionen-Batterien - Kosten pro kWh bis 2023. Abgerufen am 17. Mai 2025.
- ↑ Das Magazin für Innovation | MIT Technology Review. Abgerufen am 17. Mai 2025.
- ↑ Chevrolet Bolt battery cells to cost “industry-leading” $145 per kWh,GM: Chevrolet Bolt Arrives In 2016, $145/kWh Cell Cost, Volt Margin Improves $3,500
- ↑ trendwende-zur-e-mobilitaet-aus-fuer-den-verbrennungsmotor. Ehemals im (nicht mehr online verfügbar); abgerufen am 17. Mai 2025. (Seite nicht mehr abrufbar. Suche in Webarchiven)
- ↑ FOCUS online: Tesla Model 3: Elektroantrieb vor dem Durchbruch? In: FOCUS online. (focus.de [abgerufen am 17. Mai 2025]).
- ↑ Gert Berckmans et al.: Cost Projection of State of the Art Lithium-Ion Batteries for Electric Vehicles Up to 2030. In: Energies. Band 10, Nr. 9, 2017, S. 1314 ff., doi:10.3390/en10091314.
- ↑ Chevrolet Bolt battery cells to cost "industry-leading" $145 per kWh,Studie zu Elektroautos: 80 Prozent Preisverfall bei Akkus zwischen 2010 und 2016
- ↑ Govind Bhutada: Breaking Down the Cost of an EV Battery Cell. 22. Februar 2022, abgerufen am 17. Mai 2025 (amerikanisches Englisch).
- ↑ n-tv NACHRICHTEN: Neuer Akku lädt E-Autos in zehn Minuten. Abgerufen am 17. Mai 2025.
- ↑ Colin McKerracher: China’s Batteries Are Now Cheap Enough to Power Huge Shifts. In: bloomberg.com. 9. Juli 2024, abgerufen am 26. Juli 2024 (englisch).
- ↑ Govind Bhutada: Visualizing China’s Dominance in Battery Manufacturing (2022-2027P). 19. Januar 2023, abgerufen am 17. Mai 2025 (amerikanisches Englisch).
- ↑ Hotzenblitz mit Lithium-Polymer Batterien Artikel zum Umbauprojekt der Firmen Kruspan Engineering und MDW-Temperatursensorik GmbH, Solar- und Elektromobil Nachrichten.
- ↑ Wenn der Akku brennt: So schwierig sind E-Autos zu löschen. 8. März 2025, abgerufen am 17. Mai 2025.
- ↑ WirtschaftsWoche. Abgerufen am 17. Mai 2025.
- ↑ Brandgefahr: Erste Fluglinien schränken Powerbank-Nutzung im Flugzeug stark ein. Abgerufen am 17. Mai 2025 (österreichisches Deutsch).
- ↑ Powerbank im Handgepäck soll Airbus-Inferno ausgelöst haben. Abgerufen am 17. Mai 2025.
- ↑ Powerbank verursachte Brand an Bord von Air-Busan-Airbus. Abgerufen am 17. Mai 2025.
- ↑ Das neue Batteriegesetz. Umweltbundesamt, 17. Dezember 2020, abgerufen am 18. Mai 2021.
Empfehlungen
Auf dieser Seite verwendete Medien
Lithium Ionen Akku Überwachungselektronik
Autor/Urheber: Simon A. Eugster, Lizenz: CC BY-SA 3.0
Wiederaufladbare NiMH-Akkus AA
Autor/Urheber: Original Author: Barrie Lawson, Lizenz: CC BY-SA 3.0
Secondary Cell Diagram of energy density converted from :Image:Image5.JPG to SVG.
Autor/Urheber: Tobias ToMar Maier, Lizenz: CC BY-SA 3.0
Bloated rechargeable batteries.
Cost reductions of windpower, solar photovoltaics, battery and LED lighting 2008-2015, September 2016
Autor/Urheber: RudolfSimon, Lizenz: CC BY-SA 3.0
Zylindrische Lithium-Ionen-Zelle (18650) vor dem Zusammenbau (im Hintergrund eine 1-Eurocent-Münze)
Beschreibung: Ein Lithium-Ionen Akku (Li-ion) für SONY-Digitalkameras der Marke Cybershot.
Starterbatterie, 12 V, 300 A, 36 Ah
Autor/Urheber: wdwd, Lizenz: CC BY 3.0
Different secondary cells and their specific energy over ambient temperature
Autor/Urheber: Henry Mühlpfordt / *File:Galvanic Cell.svg: Gringer, Lizenz: CC BY-SA 3.0
Galvanische Zelle