Adenosin-Desaminase
| Adenosin-Desaminase | ||
|---|---|---|
 | ||
| Bändermodell der ADA vom Hausrind (Bos taurus) mit zentralem Zink, nach PDB 1VFL | ||
Vorhandene Strukturdaten: 3iar | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 362 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Homodimer | |
| Kofaktor | Zink | |
| Bezeichner | ||
| Gen-Name | ADA | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 3.5.4.4, Aminohydrolase | |
| Reaktionsart | Hydrolyse | |
| Substrat | Adenosin + H2O | |
| Produkte | Inosin + NH3 | |
| Vorkommen | ||
| Homologie-Familie | Hovergen | |
| Übergeordnetes Taxon | Lebewesen | |
| Ausnahmen | Pflanzen[1] | |
| Orthologe | ||
| Mensch | Hausmaus | |
| Entrez | 100 | 11486 |
| Ensembl | ENSG00000196839 | ENSMUSG00000017697 |
| UniProt | P00813 | P03958 |
| Refseq (mRNA) | NM_000022 | NM_001272052 |
| Refseq (Protein) | NP_000013 | NP_001258981 |
| Genlocus | Chr 20: 44.62 – 44.65 Mb | Chr 2: 163.73 – 163.75 Mb |
| PubMed-Suche | 100 | 11486 |
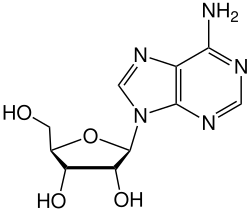
Die Adenosin-Desaminase (ADA) ist das Enzym, das die Umwandlung von Adenosin zu Inosin katalysiert. Diese Reaktion ist Teil des Recyclings der Purinnukleotide in allen Lebewesen außer den Pflanzen. Beim Menschen kommt ADA in allen Geweben vor, besonders aber in T-Lymphozyten, wo sie, gebunden an DPP4 in den Zellkontakten zwischen Lymphozyt und Epithel lokalisiert ist und daher eine wichtige Rolle bei der Immunreaktion spielt. Mutationen im ADA-Gen können zu ADA-Mangel und dieser zu einer angeborenen schweren Störung des Immunsystems (SCID) führen.[2]
Erhöhte Spiegel lassen sich in serösen Körperflüssigkeiten bei Infektionen mit Mycobakterien (z. B. bei Tuberkulose) als hoch sensitive Nachweismethode feststellen.[3]
Neben der Bindung an DPP4 stabilisiert ADA den A1-Adenosinrezeptor in der Plasmamembran. Hemmung der ADA in einem Modell für Colitis führte zu einem Rückgang der Entzündungswerte.[4][5]
Klinische Bedeutung
Der Hereditäre Adenosindesaminase-Mangel ist eine sehr seltene angeborene Stoffwechselstörung, bei der die Synthese von dADP, dGDP, dUDP und dCDP gehemmt ist. Der Grund dafür ist eine indirekte Hemmung der Ribonukleotid-Reduktase. Die Adenosin-Desaminase desaminiert Adenosin zu Inosin und Desoxyadenosin zu Desoxyinosin. Bei einem Enzymmangel kommt es deswegen u. a. zu einer Akkumulation von Desoxyadenosin, welches vermehrt zu dATP phosphoryliert wird. Erhöhte Konzentrationen von dATP hemmen die Ribonukleotid-Reduktase, wodurch die Synthese der anderen Desoxyribonukleotide gehemmt wird. Infolgedessen kommt es zu einer Störung der DNA-Synthese, die vor allem die Proliferation der Lymphozyten behindert. Die Betroffenen entwickeln u. a. einen schweren Immundefekt (Severe Combined Immunodeficiency, SCID).
Katalysierte Reaktion
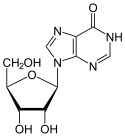
Die Desaminierung von Adenosin führt zur Bildung von Inosin.
Weblinks
- D’Eustachio / reactome: (2'-deoxy)adenosine + H2O ⇒ (2'-deoxy)inosine + NH3
Einzelnachweise
- ↑ Suchergebnis UniProt EC 3.5.4.4
- ↑ UniProt P00813
- ↑ Mathur PC, Tiwari KK, Trikha S and Tiwari D: Diagnostic Value of Adenosine Desaminase (ADA) Activity in Tubercular Serositis. In: Indian J Tuberc. 53. Jahrgang, Nr. 1, 2006, S. 92–95.
- ↑ Gracia E, Cortés A, Meana JJ, et al.: Human adenosine deaminase as an allosteric modulator of human A(1) adenosine receptor: abolishment of negative cooperativity for [H](R)-pia binding to the caudate nucleus. In: J. Neurochem. 107. Jahrgang, Nr. 1, Oktober 2008, S. 161–170, doi:10.1111/j.1471-4159.2008.05602.x, PMID 18680557.
- ↑ Antonioli L, Fornai M, Colucci R, et al.: Inhibition of adenosine deaminase attenuates inflammation in experimental colitis. In: J. Pharmacol. Exp. Ther. 322. Jahrgang, Nr. 2, August 2007, S. 435–442, doi:10.1124/jpet.107.122762, PMID 17488880.
Auf dieser Seite verwendete Medien
Struktur von Adenosin
Struktur von Inosin
Ribbon diagram of bovine adenosine deaminase.
Created using Accelrys DS Visualizer Pro 1.6 and the GIMP.