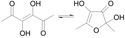
Acetylformoin
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Acetylformoin | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | C6H8O4 | ||||||||||||
| Kurzbeschreibung | Intensiv karamellartig riechender[1] Feststoff mit bitterem Geschmack[2] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 144,13 g·mol−1 | ||||||||||||
| Aggregatzustand | fest[2] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Acetylformoin ist ein sehr reaktives Abbauprodukt von Kohlenhydraten (Hexosen) wie der Glucose. Die Substanz ist ein Diketo-Endiol (Redukton) mit sechs Kohlenstoffatomen, die z. B. bei der Maillard-Reaktion als Zwischenprodukt entsteht und intensiv nach Karamell riecht.
Darstellung
Die Prozesse bei der Maillard-Reaktion sind sehr komplex und führen bei genügend hohen Temperaturen zu Melanoidinen, wobei Acetylformoin als reaktive Zwischenstufe gebildet wird.[4] Formal entsteht das Acetylformoin unter Abspaltung zweier Wassermoleküle aus Glucose über sogenannte Desoxyosone:[5]
Bei der Reaktion von Disacchariden entstehen strukturell sehr ähnliche, substituierte Derivate des Acetylformoins.[4]
Eigenschaften
Acetylformoin kann sowohl in einer offenkettigen Form, als auch wie die Kohlenhydrate in einer cyclischen „Furanose“-Halbacetal-Form vorkommen. Die Verbindung ist sehr reaktiv und bildet bei der weiteren Maillard-Reaktion mit Aminosäuren oder Proteinen Melanoidine wie das Pronyl-Lysin. Allgemeiner entstehen Aminohexosereduktone bzw. Glycosylamine.[4] Acetylformoin selbst besitzt einen bitteren Geschmack.[2] Die offenkettige Form riecht intensiv nach Karamell, wohingegen die cyclische Ketalform geruchlos ist. In protischen Lösungsmitteln wie Wasser wird sofort die ringförmige, nicht riechende Form gebildet.[1][6]
Siehe auch
Einzelnachweise
- ↑ a b Wolfgang Engel: Geruchsaktive Verbindungen aus der Maillard-Reaktion schwefelfreier sowie schwefelhaltiger Aminkomponenten mit Fructose (Memento vom 28. September 2007 im Internet Archive), Deutsche Forschungsanstalt für Lebensmittelchemie, 1999.
- ↑ a b c Kirsten Zeiter: Neue Methoden zur Synthese konformativ eingeschränkter Peptidmimetika, 11. September 2001, Ludwig-Maximilians-Universität München.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b c Anke Hollnagel: Beiträge zur Chemie der nichtenzymatischen Bräunung von oligomeren Kohlenhydraten, TU Berlin, 19. April 2000 (PDF; 818 kB).
- ↑ Wolfgang Legrum: Riechstoffe, zwischen Gestank und Duft. Springer Fachmedien, Wiesbaden 2015, ISBN 978-3-658-07309-1, S. 117, doi:10.1007/978-3-658-07310-7_5.
- ↑ Deutsche Forschungsanstalt für Lebensmittelchemie: Jahresbericht (Memento vom 28. September 2007 im Internet Archive), 2001.
Auf dieser Seite verwendete Medien
Synthesis of Acetylformoine
Chemical structure of Acetylformoine