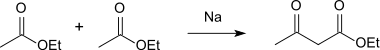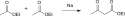Acetessigsäure
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Acetessigsäure | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | C4H6O3 | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 102,09 g·mol−1 | ||||||||||||
| Aggregatzustand | flüssig bzw. fest[1] | ||||||||||||
| Schmelzpunkt | |||||||||||||
| pKS-Wert | 3,6 (25 °C)[2] | ||||||||||||
| Löslichkeit | mischbar mit Wasser[1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||
Acetessigsäure ist der Trivialname der 3-Oxobutansäure. Das Anion der Säure wird Acetoacetat oder auch Acetacetat genannt.
Gewinnung und Darstellung
Acetessigsäure wird durch Verseifen (Hydrolyse) von Acetessigsäureethylester und anschließende Umsetzung mit Säuren hergestellt. Eine weitere Möglichkeit der Darstellung ist die Oxidation von Buttersäure mit Wasserstoffperoxid.
Bei der Reaktion von Essigsäureethylester mit Natrium entsteht in einer Claisen-Kondensation Acetessigsäureethylester, der durch Esterspaltung in die reine Säure umgewandelt werden kann.[4]
Eigenschaften
Bei Acetessigsäure liegt eine Keto-Enol-Tautomerie vor. Infolge des induktiven Effekts der Ketogruppe reagiert Acetessigsäure saurer als die ihr zugrundeliegende Buttersäure.
Mit elementarem Chlor oder Brom zersetzt sich Acetessigsäure in Kohlendioxid, den entsprechenden Halogenwasserstoff und Chloraceton bzw. Bromaceton.[5]
Verwendung
Reine Acetessigsäure wird kaum verwendet, da sie sich leicht unter Decarboxylierung in Kohlenstoffdioxid und Aceton zersetzt (schnell bei 100 °C).[4] Wichtiger sind ihre Ester und Salze.
Biologische Bedeutung
Acetessigsäure (Acetoacetat) tritt wie ihr Isomer 2-Oxobutansäure als Zwischenprodukt im Stoffwechsel auf, zählt zu den Ketokörpern und hat besondere Bedeutung beim Katabolismus bei Hunger oder Diät. Dabei wird im Hungerzustand entstandenes Acetyl-CoA, über ein Zwischenprodukt (3-Hydroxy-3-methylglutaryl-CoA), zu Acetoacetat umgebaut.
Einzelnachweise
- ↑ a b c Eintrag zu Acetessigsäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 15. Juni 2014.
- ↑ W. M. Haynes (Hrsg.): CRC Handbook of Chemistry and Physics. 97. Auflage. (Internet-Version: 2016), CRC Press / Taylor and Francis, Boca Raton FL, Dissociation Constants of Organic Acids and Bases, S. 5-88.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b F. Beilstein: Handbuch der organischen Chemie, 3. Auflage, 1. Band. Verlag Leopold Voss, 1893. S. 591. Volltext
- ↑ R. Otto: Analogien zwischen Ketonsäuren und alkylsulfonirten Fettsäuren in Berichte der deutschen chemischen Gesellschaft 1888, 21, S. 89–94. Volltext
Literatur
- Beilstein E III 3; 1178
- Horton Robert, Biochemie; S. 687
Weblinks
Auf dieser Seite verwendete Medien
Autor/Urheber: MegaByte07, Lizenz: CC BY-SA 3.0
3-Oxobutyric acid KetoEnol
Autor/Urheber: MegaByte07, Lizenz: CC BY-SA 3.0
Decomposition 3-Oxobutyric acid
Struktur von Acetessigsäure
Autor/Urheber: MegaByte07, Lizenz: CC BY-SA 3.0
Synthesis 3-Oxobutyric acid
3-Oxobutyric acid Reaction Chlorine
Autor/Urheber: MegaByte07, Lizenz: CC BY-SA 3.0
Synthesis 3-Oxobutyric acid