ABC-Transporter
| ABC-Transporter | ||
|---|---|---|
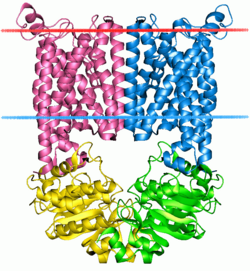 | ||
| Bänderdarstellung des Vitamine B12 transporter-like ABC transporters (BtuCD) nach PDB 1l7v (rote Linie = Extracellular face, blaue Linie = Cytoplasmic face) | ||
| Transporter-Klassifikation | ||
| TCDB | 3.A.1 | |
| Bezeichnung | ABC-Transporter Superfamilie | |
| Enzymklassifikation | ||
| EC, Kategorie | 3.6.3.-, Hydrolase | |
| Substrat | Substrat (in/out) + ATP | |
| Produkte | Substrat (out/in) + Adenosindiphosphat + Phosphat | |
ABC-Transporter bilden eine große Familie von Membranproteinen, die als gemeinsames Strukturelement eine ATP-bindende Kassette (von englisch: ATP binding cassette, ABC) besitzen und spezifische Substrate aktiv über eine Zellmembran transportieren.
Allgemeines
Wenn die Substrate von ABC-Transportern gegen einen Konzentrationsgradienten transportiert werden, muss für den Vorgang Energie aufgewandt werden; das geschieht durch die Bindung und Hydrolyse von ATP an der ABC-Einheit. ABC-Transporter gehören damit zu den primär aktiven Transportern einerseits und zu den membranständigen ATPasen andererseits.
Die ABC-Transporter-Superfamilie umfasst eine der größten bekannten Proteinfamilien, mit Mitgliedern in fast jedem Organismus, vom Bakterium bis zum Säugetier. Auch Pflanzen besitzen ABC-Transporter. Die ABC-Transporter werden im Menschen in den meisten sezernierenden Epithelien, einschließlich Leber und Darm, exprimiert. Die ABC-Transporter rückten in den letzten Jahren in das Licht des Interesses, als erkannt wurde, dass sie eine beträchtliche medizinische, industrielle und ökonomische Bedeutung haben. So spielen sie eine große Rolle bei Resistenzen von potentiell pathogenen Bakterien gegen Antibiotika und Antimykotika und bei Pflanzen bei der Resistenz gegen Herbizide. Beim Menschen können Mutationen in einem Gen, das für einen ABC-Transporter kodiert, zu verschiedenen Stoffwechselkrankheiten führen. Starke Expression der ABC-Transporter in Tumorgeweben lässt oft die Chemotherapie fehlschlagen.
Alle eukaryotischen ABC-Transporter sind Exporter. Einige sind sehr substratspezifisch, andere multispezifisch. Alle ABC-Transporter sind aktive Transporter, da die ATP-Bindung und -Hydrolyse den Transportprozess antreiben. Eine bekannte Ausnahme ist CFTR (Cystic Fibrosis Transmembrane Conductance Regulator), da die ABC-Casette lediglich das Öffnen und Schließen des Chlorid-Ionenkanals steuert. Der CFTR ist also ein Chlorid-Ionenkanal mit einem Sulphonylrezeptor (SUR1) der als Regulator des Ionenkanals dient. Die Mutation beider Allele des CFTR-Gens führt zur sog. zystischen Fibrose (Mukoviszidose). Dabei entsteht ein zäher Schleim in der Lunge und im Verdauungstrakt, was eine Neigung zu Infektionskrankheiten bewirkt.
Normalerweise liegt ein eukaryotischer ABC-Transporter als Dimer vor, wobei jedes der Monomere aus einer hydrophoben Transmembran-Domäne (TMD) und einer hydrophilen, die ATP-bindende-Kassette enthaltenden Domäne besteht. Die hydrophobe Permeasedomäne vermittelt den Transport des Substrats und ist für die Spezifität verantwortlich. Beim Menschen sind die meisten der bisher 49 bekannten ABC-Transporter jedoch Monomere, die aber ebenfalls aus insgesamt zwei TMD und zwei ATP bindenden Kassetten bestehen. Prokaryotische ABC-Transporter sind in der Regel Tetramere aus zwei membrandurchspannenden Permeaseuntereinheiten, die den eigentlichen Transport bewerkstelligen, und zwei ATPaseuntereinheiten. Nach derzeitigem Erkenntnisstand binden die ATPaseuntereinheiten spezifisch „ihre“ Permeaseuntereinheit. Ein funktioneller Transporter kann sowohl zwei verschiedene PermeaseUEs und ATPaseUEs, als auch aus zwei Homodimeren, oder aus einer Kombination von Homo- und Heterodimeren bestehen.
Unterfamilien und Mitglieder
Die Familie der menschlichen ABC-Transporter lässt sich in sieben Unterfamilien (ABCA-G) mit insgesamt 49 verschiedenen Genen und 21 verschiedenen Pseudogenen einteilen.[1]
| Name der Unterfamilie | Mitglied (Genname) | Codierendes Chromosom |
|---|---|---|
| ABCA | ABCA1 | 9 |
| ABCA2 | 9 | |
| ABCA3 | 16 | |
| ABCA4 | 1 | |
| ABCA5 | 17 | |
| ABCA6 | 17 | |
| ABCA7 | 19 | |
| ABCA8 | 17 | |
| ABCA9 | 17 | |
| ABCA10 | 17 | |
| ABCA12 | 2 | |
| ABCA13 | 7 | |
| ABCB | ABCB1 | 7 |
| ABCB2 | 6 | |
| ABCB3 | 6 | |
| ABCB4 | 7 | |
| ABCB5 | 7 | |
| ABCB6 | 2 | |
| ABCB7 | X | |
| ABCB8 | 7 | |
| ABCB9 | 12 | |
| ABCB10 | 1 | |
| ABCB11 | 2 | |
| ABCC | ABCC1 | 16 |
| ABCC2 | 10 | |
| ABCC3 | 17 | |
| ABCC4 | 13 | |
| ABCC5 | 3 | |
| ABCC6 | 16 | |
| ABCC7 | 7 | |
| ABCC8 (=SUR1-Untereinheit des ATP-sensitiven Kaliumkanals) | 11 | |
| ABCC9 | 12 | |
| ABCC10 | 6 | |
| ABCC11 | 16 | |
| ABCC12 | 16 | |
| ABCC13 | 21 | |
| ABCD | ABCD1 | X |
| ABCD2 | 12 | |
| ABCD3 | 1 | |
| ABCD4 | 14 | |
| ABCE | ABCE1 | 4 |
| ABCF | ABCF1 | 6 |
| ABCF2 | 7 | |
| ABCF3 | 3 | |
| ABCG | ABCG1 | 21 |
| ABCG2 | 4 | |
| ABCG4 | 11 | |
| ABCG5 | 2 | |
| ABCG8 | 2 |
Erbkrankheiten
Defekte in der Funktion der ABC-Transporter können verschiedenste Erkrankungen auslösen. Dazu zählen die zystische Fibrose (Mukoviszidose), Tangier-Krankheit, Adrenoleukodystrophie und spezielle Formen der spinocerebellären Ataxie.
Ein Defekt in ABCC11 ist dagegen weltweit ausgesprochen häufig. Beispielsweise bei nahezu 100 % der koreanischen Bevölkerung. Der Defekt führt zu keiner Erkrankung, sondern bewirkt unter anderem, dass die Träger dieses Merkmals einen nur sehr schwachen Körpergeruch und weißen, trockenen Ohrenschmalz haben.[2]
Multiple Drug Resistance
Der MDR1-Transporter ist der erste im Menschen charakterisierte ABC-Transporter. MDR steht für Multiple Drug Resistance und bedeutet etwa „Resistenz gegen mehrere Medikamente“. Am Transporter beteiligt sind das Multiple Drug Resistance Protein 1 (MDR 1) und das Multidrug Resistance-Related Protein 1 (MRP1).
MDR-Transporter kommen u. a. in der Blut-Hirn-Schranke, aber auch in Tumorzellen vor.
In der Blut-Hirn-Schranke verhindert dieser Transportertyp beispielsweise die zentrale Wirkung von Loperamid, einem Opioid.
In Krebszellen kann der Transporter eine unerwünschte Wirkung entfalten. Krebszellen mit hoher MDR-Expression können im Rahmen einer Chemotherapie eine erhöhte Toleranz gegenüber Cytostatika aufweisen.
Literatur
- Amy Davidson & Jue Chen (2004): ATP-Binding Cassette Transporters in Bacteria. In: Annual Reviews of Biochemistry. Bd. 73, S. 241–268. PMID 15189142 (englisch)
- Michael Dean (2002): The Human ATP-Binding Cassette (ABC) Transporter Superfamily. (online beim NIH, englisch)
Einzelnachweise
- ↑ Vasilis Vasiliou, Konstandinos Vasiliou und Daniel W. Nebert: Human ATP-binding cassette (ABC) transporter family. In: Human Genomics. 3. Jahrgang, Nr. 3, 2009, S. 281–290, doi:10.1186/1479-7364-3-3-281, PMC 2752038 (freier Volltext) – (englisch).
- ↑ T. Ishikawa, Y. Toyoda u. a.: Pharmacogenetics of human ABC transporter ABCC11: new insights into apocrine gland growth and metabolite secretion. In: Frontiers in genetics. Band 3, 2012, ISSN 1664-8021, S. 306, doi:10.3389/fgene.2012.00306, PMID 23316210, PMC 3539816 (freier Volltext). (Open Access, englisch)
Weblinks
- ABC-Transporter bei TC-DB
- ABC-Transporter bei KEGG (grafische Übersicht)
Auf dieser Seite verwendete Medien
Autor/Urheber: Andrei Lomize, Lizenz: CC BY-SA 3.0
Structure of the Escherichia coli BtuCD protein, an ABC transporter that mediates vitamin B12 uptake. Protein image from OPM database
