5-HT1B-Rezeptor
| 5-HT1B-Rezeptor | ||
|---|---|---|
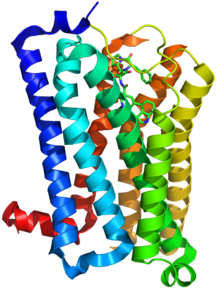 | ||
| Strukturmodel des 5-HT1B-Rezeptors in Komplex mit Ergotamin | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 390 AS; 43,6 kDa | |
| Sekundär- bis Quartärstruktur | 7TM | |
| Bezeichner | ||
| Gen-Name | HTR1B | |
| Externe IDs | ||
| Vorkommen | ||
| Homologie-Familie | Hovergen | |
| Übergeordnetes Taxon | Wirbeltiere | |
Der 5-HT1B-Rezeptor (kurz 5-HT1B, früher auch 5-HT1Dβ-Rezeptor, von 5-Hydroxytryptamin (Serotonin)) ist ein Protein aus der Familie der Serotonin-Rezeptoren (5-HT-Rezeptoren), das durch Serotonin, einem körpereigenen Gewebshormon und Neurotransmitter, aktiviert werden kann. Im menschlichen Körper kommt der 5-HT1B-Rezeptor insbesondere in der Zellmembran von Zellen der glatten Muskulatur und des Zentralnervensystems vor. Dieser Rezeptor hat im Zusammenspiel mit seinem Agonisten Serotonin eine wichtige Rolle bei der Signalweiterleitung im Nervensystem (Neurotransmission). Auf molekularer Ebene vermittelt dieser G-Protein-gekoppelte Rezeptor seine Effekte über eine Aktivierung von heterotrimären G-Proteinen. Arzneistoffe, welche 5-HT1B-Rezeptoren stimulieren, werden in der Akutbehandlung der Migräne eingesetzt.
Biochemie
Genetik
Der 5-HT1B-Rezeptor des Menschen wurde erstmals im Jahr 1992 kloniert.[1] Er wird durch ein Gen auf dem Chromosom 6 auf dem Genlocus 6q13, dem HTR1B-Gen codiert. Die codierende DNA-Region ist intronfrei. Mit einer Sequenzübereinstimmung von 63 % (77 % in den Transmembranregionen) ist der menschliche 5-HT1B-Rezeptor sehr nah mit dem 5-HT1D-Rezeptor verwandt.
Proteinstruktur
Das 5-HT1B-Rezeptorprotein des Menschen besteht aus 390 Aminosäuren. Mit Hilfe der Röntgenkristallstrukturanalyse konnte eine vorausgesagte Struktur mit sieben helikalen Transmembrandomänen (heptahelikaler Rezeptor) bestätigt werden.[2]
Liganderkennung: Die orthosterische Bindungskavität liegt im tieferen Innenbereich des Rezeptors und wird festgelegt durch die Helizes III, V, VI, VII und ECL2. Sie ist weniger polar als jene in Rezeptoren anderer Monoamine, wie etwa Noradrenalin, Dopamin oder Histamin. Liganden mit Tryptamin-Grund- oder Teilstruktur bilden über ihre Aminfunktion eine Salzbrücke mit der Carboxygruppe eines Asparaginsäure-Glieds des Rezeptors. Diese ionogene Bindungsstelle findet sich auch bei anderen Monoaminrezeptoren. Das stickstoffgebundene Wasserstoffatom des Indols bildet über die Hydroxygruppe eines Threonins eine Wasserstoffbrückenbindung aus. Dieses Bindungsmuster ist in der Familie der Serotoninrezeptoren weit verbreitet. Das Indol wird seitlich eingerahmt von Serin- und Alanin-Resten der Helix V. An die Bindungstasche im Rezeptorkern schließt sich eine weitere Tasche an, die sich im extrazellulären Eingangsbereich des Rezeptors befindet und Ligandanteile aufnehmen kann, wie sie in Ergotaminen als größerer Tripeptidrest des Lysergamids anzutreffen sind. Der Tripeptidrest scheint aber wenig zur Affinität beizutragen. In dieser Tasche wird eine allosterische Bindungsstelle vermutet.[2]
Es gibt artspezifische Unterschiede des Rezeptors, die sich darin äußern, dass die Affinität einiger adrenerger Liganden am 5-HT1B-Rezeptor bei Nagetieren deutlich höher ist als beim Menschen.[2]
Signaltransduktion
Auf molekularer Ebene führt eine Stimulation von 5-HT1B-Rezeptoren zu einer Aktivierung von Gi/o-Proteinen und einer Hemmung der Adenylylcyclasen sowie einer Öffnung von Kaliumkanälen. Des Weiteren bewirkt eine Stimulation von 5-HT1B-Rezeptoren eine Aktivierung der Phospholipasen C und D, der NO-Synthasen und des ERK-Signalwegs.[3]
Funktion
Zentralnervensystem
Im Zentralnervensystem kommen 5-HT1B-Rezeptoren insbesondere an Nervenendigungen vor. Eine besonders hohe Dichte dieser Rezeptoren ist in den Basalganglien, im Striatum und im frontalen Cortex zu finden. Neuronale 5-HT1B-Rezeptoren können als präsynaptische Rezeptoren die Freisetzung von Serotonin kontrollieren (Autorezeptoren). Darüber hinaus hemmen sie als Heterorezeptoren die Freisetzung anderer Neurotransmitter, wie beispielsweise die Freisetzung von Acetylcholin, Dopamin, Glutamat, Noradrenalin und GABA. Darüber hinaus hemmt die Aktivierung von 5-HT1B-Rezeptoren die Freisetzung entzündungsvermittelnder Peptide, wie beispielsweise Calcitonin Gene-Related Peptide. 5-HT1B-Rezeptoren des Zentralnervensystems spielen bei Aggression, Angst, Stimmung, Sucht, Sexualverhalten, Fortbewegung sowie beim Lernen eine Rolle.[4]
Herz-Kreislauf-System
Über eine Stimulierung von 5-HT1B-Rezeptoren führt Serotonin zu einer Kontraktion der glatten Muskulatur des Herz-Kreislaufsystems. Sie sind neben den 5-HT2A-Rezeptoren die wichtigsten Blutgefäß kontrahierenden Serotoninrezeptoren. Insbesondere im Lungenkreislauf ist dieser Rezeptor an der Regulation des Blutgefäßtonus beteiligt. Von besonderer Bedeutung ist ebenso die 5-HT1B-Rezeptor-vermittelte Kontraktion intrakranieller Arterien der Koronararterien.[5]
Pharmakologie


Der 5-HT1B-Rezeptor besitzt nicht nur eine sehr enge genetische und strukturelle Verwandtschaft zum 5-HT1D-Rezeptor. Auch pharmakologisch sind beide Rezeptoren nur schwer voneinander zu unterscheiden.
Agonisten
5-HT1B-Rezeptoragonisten werden wegen ihrer kontrahierenden Wirkung auf Intrakranialarterien und Hemmung der Freisetzung von Entzündungsmediatoren in der Akutbehandlung des Migräneanfalls eingesetzt. Zu den therapeutisch genutzten nicht-selektiven 5-HT1B-Rezeptoragonisten zählen die Mutterkornalkaloide, wie beispielsweise Ergotamin.
Eine vergleichsweise höhere Selektivität besitzt das experimentell genutzte 5-Carboxamidotryptamin, ein 5-HT1/7-Rezeptoragonist. Auf der Basis seiner Struktur wurden selektive 5-HT1B/1D-Rezeptoragonisten, die heute in der Akuttherapie der Migräne als Mittel der ersten Wahl genutzten Triptane, entwickelt. 1991 wurde mit Sumatriptan der erste Vertreter dieser Stoffklasse zugelassen. Es folgten daraufhin Naratriptan, Rizatriptan, Eletriptan, Zolmitriptan, Almotriptan und Frovatriptan, die sich vom Prototyp Sumatriptan hauptsächlich in ihrer Pharmakokinetik unterscheiden.
Cabergolin zeigt im Vergleich zu etlichen anderen Liganden an diesem Rezeptor eine nennenswerte Bevorzugung der Signalübertragung durch β-Arrestin, mit einem Bias-Faktor von 70.[6]
Antagonisten
Im Gegensatz zum 5-HT1B-Rezeptoragonismus findet der 5-HT1B-Rezeptorantagonismus bisher keine therapeutische Nutzung. Ungeachtet dessen besitzen neben Mutterkornalkaloidderivaten auch einige andere Arzneistoffe, wie beispielsweise das Antipsychotikum Methiothepin und das zur Behandlung von Erektionsstörungen genutzte Yohimbin, relevante 5-HT1B-rezeptorantagonistische Eigenschaften.
Selektive 5-HT1B-Rezeptorantagonisten, wie beispielsweise SB-216,641, finden insbesondere in der Forschung und Entwicklung experimentelle Anwendung.
Weblinks
Einzelnachweise
- ↑ Weinshank RL, Zgombick JM, Macchi MJ, Branchek TA, Hartig PR: Human serotonin 1D receptor is encoded by a subfamily of two distinct genes: 5-HT1D alpha and 5-HT1D beta. In: Proc. Natl. Acad. Sci. U.S.A. Band 89, Nr. 8, April 1992, S. 3630–4, PMID 1565658, PMC 48922 (freier Volltext).
- ↑ a b c Wang C, Jiang Y, Ma J, et al.: Structural Basis for Molecular Recognition at Serotonin Receptors. In: Science. März 2013, doi:10.1126/science.1232807, PMID 23519210.
- ↑ John R. Raymond, Justin H. Turner, Andrew K. Gelasco et al.: The Serotonin Receptors: From Molecular Pharmacology to Human Therapeutics. Hrsg.: Bryan L. Roth. Springer, 2006, ISBN 1-59745-080-4, 5-HT Recepto Signal Transduction Pathways, S. 143–206.
- ↑ Pytliak M, Vargová V, Mechírová V, Felšöci M: Serotonin receptors – from molecular biology to clinical applications. In: Physiol Res. Band 60, Nr. 1, 2011, S. 15–25, PMID 20945968.
- ↑ Kaumann AJ, Levy FO: 5-hydroxytryptamine receptors in the human cardiovascular system. In: Pharmacol. Ther. Band 111, Nr. 3, September 2006, S. 674–706, PMID 16960982.
- ↑ Wacker D, Wang C, Katritch V, et al.: Structural Features for Functional Selectivity at Serotonin Receptors. In: Science. 2013, doi:10.1126/science.1232808, PMID 23519215.
Auf dieser Seite verwendete Medien
Struktur von Ergotamin
Sumatriptan
Autor/Urheber: S. Jähnichen, Lizenz: CC BY-SA 3.0
3D structure model of the 5-HT1B receptor in complex with ergotamine based on crystallographic data for PDB 4IAR


