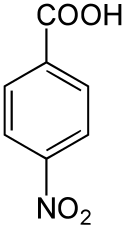
4-Nitrobenzoesäure
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 4-Nitrobenzoesäure | ||||||||||||||||||
| Summenformel | C7H5NO4 | ||||||||||||||||||
| Kurzbeschreibung | hellgrünes geruchloses kristallines Pulver[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 167,12 g·mol−1 | ||||||||||||||||||
| Aggregatzustand | fest | ||||||||||||||||||
| Dichte | 1,61 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| pKS-Wert | 3,42[2] | ||||||||||||||||||
| Löslichkeit | sehr schwer in Wasser (0,42 g·l−1 bei 20 °C)[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 | −392,2 kJ/mol[3] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Die 4-Nitrobenzoesäure ist eine organisch chemische Verbindung und zählt zu den Aromaten. Die Struktur besteht aus einem Benzolring mit angefügter Carboxygruppe (–COOH) und Nitrogruppe (–NO2) als Substituenten. Sie leitet sich sowohl von der Benzoesäure als auch vom Nitrobenzol ab und gehört zur Stoffgruppe der Nitrobenzoesäuren. Die 4-Nitrobenzoesäure findet vor allem Verwendung in der Analyse organischer Substanzen.
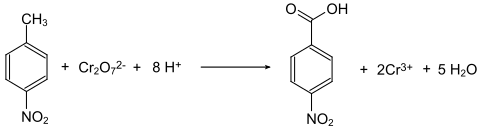
Darstellung
4-Nitrotoluol wird mit Natriumdichromat in Gegenwart von konzentrierter Schwefelsäure zur 4-Nitrobenzoesäure oxidiert.[4]
Eigenschaften
Die 4-Nitrobenzoesäure ist ein gelblich kristalliner Feststoff. Sie weist aufgrund des −M-Effekts der Nitrogruppe eine höhere Acidität im Vergleich zur Benzoesäure auf. Der pKs-Wert mit 3,42 ist daher entsprechend niedriger (Benzoesäure: 4,20[5]).

COSMO-Oberfläche der 4-Nitrobenzoesäure
(blau = negative, rot = positive Ausgleichsladung)
Die mittels DSC bestimmte Zersetzungswärme beträgt −373 kJ·mol−1 bzw. −2234 kJ·kg−1.[6]
Verwendung
Die 4-Nitrobenzoesäure findet vor allem Verwendung in der Analyse organischer Substanzen durch Derivatisierung. Flüssige Substanzen oder solche mit niedrigem Schmelzpunkt werden dazu in leicht kristallisierende Derivate umgewandelt: Alkohole können beispielsweise durch die Messung der Schmelzpunkte ihrer Ester der 4-Nitrobenzoesäure oder der 3,5-Dinitrobenzoesäure identifiziert werden. Hierzu wird die zu analysierende Substanz mit 4-Nitrobenzoesäure in Gegenwart geringer Mengen Schwefelsäure umgesetzt.

Nachweis von Isopropanol als Derivat der 4-Nitrobenzoesäure:
4-Nitrobenzoesäure-2-propylester (Smp.: 100,5 °C[5]).
Die Schmelzpunkte dieser Derivate sind in der Regel scharf. Diese Umsetzung ist auch für zahlreiche Amine geeignet.
Die Derivate der 3,5-Dinitrobenzoesäure besitzen in der Regel höhere Schmelzpunkte als die der 4-Nitrobenzoesäure.[5] Sie werden dann bevorzugt gewählt, wenn der Schmelzpunkt mit der 4-Nitrobenzoesäure zu niedrig ist und keine genaue Bestimmung mehr möglich wird.
Ist die fragliche Substanz empfindlicher, so erfolgt stattdessen die direkte Umsetzung mit dem entsprechenden Säurechlorid, dem 4-Nitrobenzoylchlorid. Auf diese Weise sind z. B. auch Derivate der Aminosäuren zugänglich.
Einzelnachweise
- ↑ a b c d e f g Eintrag zu 4-Nitrobenzoesäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 14. Januar 2020. (JavaScript erforderlich)
- ↑ Beyer/Walter: Lehrbuch der Organischen Chemie, 19. Auflage, S. Hirzel Verlag, Stuttgart 1981, ISBN 3-7776-0356-2, S. 511.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-34.
- ↑ O. Kamm, A. O. Matthews: p-Nitrobenzoic acid In: Organic Syntheses. 2, 1922, S. 53, doi:10.15227/orgsyn.002.0053; Coll. Vol. 1, 1941, S. 392 (PDF).
- ↑ a b c CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, ISBN 0-8493-0303-6.
- ↑ Grewer, T.; Klais, O.: Exotherme Zersetzung - Untersuchungen der charakteristischen Stoffeigenschaften, VDI-Verlag, Schriftenreihe "Humanisierung des Arbeitslebens", Band 84, Düsseldorf 1988, ISBN 3-18-400855-X, S. 9.
Weblinks
- Eintrag zu 4-Nitrobenzoesäure. In: P. J. Linstrom, W. G. Mallard (Hrsg.): NIST Chemistry WebBook, NIST Standard Reference Database Number 69. National Institute of Standards and Technology, Gaithersburg MD, abgerufen am 20. Dezember 2013.
Auf dieser Seite verwendete Medien
Autor/Urheber: Andreas Klamt, Lizenz: CC BY-SA 3.0
COSMO Oberfläche der 4-Nitrobenzoesäure
4-Nitrobenzoesäure; p-Nitrobenzoesäure
Autor/Urheber: Roland Mattern, Lizenz: CC BY-SA 3.0
Darstellung von 4-Nitrobenzoesäure
Autor/Urheber: Roland Mattern, Lizenz: CC BY-SA 3.0
Darstellung von 4-Nitrobenzoesäure-2-propylester