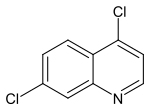
4,7-Dichlorchinolin
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 4,7-Dichlorchinolin | ||||||||||||||||||
| Summenformel | C9H5Cl2N | ||||||||||||||||||
| Kurzbeschreibung | hellgelbes Pulver[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 198,05 g·mol−1 | ||||||||||||||||||
| Aggregatzustand | fest[1] | ||||||||||||||||||
| Schmelzpunkt | 81–83 °C[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
4,7-Dichlorchinolin ist eine heterocyclische Verbindung aus der Stoffgruppe der Chinoline, welche in der Herstellung von Malaria-Medikamenten Bedeutung hat. Sowohl das Chloroquin als auch das Amodiaquin lassen sich aus dem 4,7-Dichlorchinolin synthetisieren.
Darstellung
4,7-Dichlorchinolin wird aus meta und Oxalessigestern durch Kondensation und anschließender Verseifung, Decarboxylierung und Chlorierung gewonnen.[2] Die einzelnen notwendigen Schritte sind: Erstens die Kondensation der Edukte unter leichtem Erwärmen in Essigsäure zum Imin. Zweitens die Cyclisierung in heißem Paraffin durch nucleophilen Angriff des Rings am Ester unter Eliminierung von Alkohol (ein weiterer Kondensationsschritt). Drittens die Verseifung des übrigen Esters in siedender Natronlauge zur Carbonsäure. Viertens die Decarboxylierung der Carbonsäure wiederum in heißem Paraffin und fünftens die Chlorierung des Alkohols in 4-Position mittels Phosphoroxychlorid. Der zweite dieser Schritte ist leichter nachzuvollziehen wenn an das Enamin-Tautomer gedacht wird. In dieser Struktur übt das Stickstoffatom nicht bloß einen Elektronen-ziehenden Effekt, sondern auf der Ebene der pi-Elektronen ebenfalls einen Elektronen-schiebenden Effekt auf den Ring aus. Bei dieser Betrachtung wird außerdem klar, dass der entstehende Ester auch als 4-Chinolon[3]-Derivat gesehen werden kann, genauso wie die weiteren Zwischenprodukte.

Eine neuere, allerdings auch aufwendigere Methode geht von 2-Acetyl-5-chloranilin aus und beinhaltet eine Ringschlussmetathese.[4] Diese Syntheseroute würde insbesondere die Anbringung von Resten in der 2-Position des Produktes ermöglichen, was in der älteren Route durch die Ketogruppe im Oxalessigester verhindert ist. Für das nicht weiter substituierte 4,7-Dichlorchinolin ist aufgrund der Vielzahl von Reagenzien und eines zusätzlichen Schrittes diese neuere Syntheseroute nicht attraktiv.
Einzelnachweise
- ↑ a b c d e Datenblatt 4,7-Dichlor-chinolin bei Sigma-Aldrich, abgerufen am 4. August 2021 (PDF).
- ↑ Alexander R. Surrey und Henry F. Hammer: Some 7-Substituted 4-Aminoquinoline Derivatives. In: JACS. Band 68, Nr. 1, Januar 1946, S. 113–116, doi:10.1021/ja01205a036.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu 4-Hydroxychinolin: CAS-Nr.: 611-36-9, EG-Nr.: 210-268-2, ECHA-InfoCard: 100.009.336, PubChem: 69141, ChemSpider: 62357, Wikidata: Q27098240.
- ↑ Chumpol Theeraladanon, Mitsuhiro Arisawa, Atsushi Nishida, Masako Nakagawa: A novel synthesis of substituted quinolines using ring-closing metathesis (RCM): its application to the synthesis of key intermediates for anti-malarial agents. In: Tetrahedron. Band 60, Nr. 13, März 2004, S. 3017–3035, doi:10.1016/j.tet.2004.01.084.
Auf dieser Seite verwendete Medien
Strukturformel von 4,7-Dichlorchinolin
Synthese von 4,7-Dichlorchinolin, beruhend auf der klassischen Carbonylchemie


