3-Hydroxypropionatzyklus
| Übergeordnet |
|---|
| Kohlenstoffdioxid-Assimilation |
| Gene Ontology |
| QuickGO |
Der 3-Hydroxypropionatzyklus, auch 3-Hydroxypropionat-Bizyklus[1] oder 3-Hydroxypropionat/Malyl-CoA-Zyklus,[2] ist ein Stoffwechselweg, durch den bestimmte Mikroorganismen Kohlenstoffdioxid (CO2) fixieren können. Hierbei werden zwei Moleküle CO2 in Form von Bicarbonat (HCO3−) zu einem Molekül Glyoxylat unter ATP- und NADPH-Verbrauch aufgebaut. Anschließend wird das entstandene Glyoxylat durch einen Folgezyklus unter Fixierung eines weiteren Moleküls Bicarbonat zu Pyruvat umgesetzt. Der 3-Hydroxypropionatzyklus wurde erstmals 1986 im phototrophen Bakterium Chloroflexus aurantiacus entdeckt.[3]
Vorkommen
Der 3-Hydroxypropionatzyklus wurde bisher nur im mikroaerophilen Grünen Nichtschwefelbakterium Chloroflexus aurantiacus nachgewiesen. Obwohl nah verwandte Bakterien (Chloroflexus aggregans, Roseiflexus spp.) die Gene für diesen Stoffwechselweg haben, wurde bei ihnen noch nicht autotrophes Wachstum nachgewiesen.[4] Ein anderer Verwandter, Oscillochloris sp., nutzt dagegen den Calvin-Zyklus und nicht den 3-Hydroxypropionatzyklus zur CO2-Fixierung.[5]
Biochemie
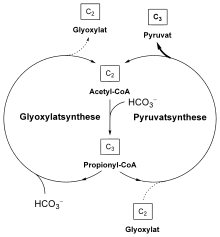
Der 3-Hydroxypropionatzyklus besteht aus zwei miteinander verbundenen Zyklen. Beim ersten Zyklus wird Glyoxylat aus zwei Molekülen Bicarbonat aufgebaut. Das Glyoxylat wird dann in einem zweiten Zyklus zu Pyruvat umgesetzt, für die Regenerierung des zweiten Zyklus wird ein weiteres Molekül Bicarbonat verwendet. Es werden also drei Moleküle Bicarbonat zu einem Molekül Pyruvat aufgebaut.
Bildung von Glyoxylat
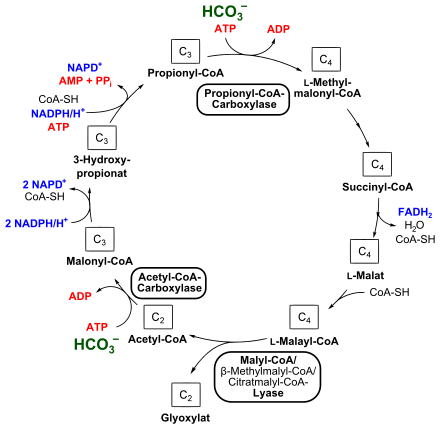
Ausgehend von Acetyl-CoA startet der Zyklus mit der Kondensation von einem Molekül Bicarbonat, bei dem auch ein Molekül ATP verbraucht wird. Diese Reaktion wird von einer Biotin-haltigen Acetyl-CoA-Carboxylase katalysiert, es entsteht Malonyl-CoA. Dieses wird zu 3-Hydroxypropionat durch eine Malonyl-CoA-Reduktase unter NADPH-Verbrauch reduziert. 3-Hydroxypropionat ist dabei die namensgebende Komponente dieses Zyklus. Die Propionyl-CoA-Synthase katalysiert die Bildung von Propionyl-CoA, bei diesem Schritt wird erneut NADPH als Reduktionsmittel benötigt.
Der zweite Schritt der Bicarbonatassimilation erfolgt bei der Umsetzung von Propionyl-CoA zu Methylmalonyl-CoA unter ATP-Verbrauch, was eine Propionyl-CoA-Carboxylase ermöglicht. Methylmalonyl-CoA wird über Succinyl-CoA und L-Malat zu L-Malyl-CoA umgelagert. Bei dieser Reaktionsfolge sind eine Epimerase, eine Mutase, eine Transferase, eine Dehydrogenase und eine Fumarase (Fumarat-Hydratase) beteiligt, wobei auch FADH2 gebildet wird.
Eine Malyl-CoA-Lyase, enzymatischer Teil des trifunktionalen Malyl-CoA/β-Methylmalyl-CoA/Citratmalyl-CoA-Lyase (siehe auch unten), spaltet schließlich L-Malyl-CoA in Glyoxylat und Acetyl-CoA, wodurch sich der Kreislauf wieder schließt.
Die Bilanz für die Bildung von Glyoxylat ist:
Bildung von Pyruvat

Bei dem folgenden zweiten Zyklus wird das aufgebaute Glyoxylat zu Pyruvat umgesetzt. Hierbei kondensieren jeweils ein Molekül Glyoxylat und Propionyl-CoA zu β-Methylmalyl-CoA, was durch die im ersten Zyklus beteiligte β-Methylmalyl-CoA-Lyase (Malyl-CoA/β-Methylmalyl-CoA/Citratmalyl-CoA-Lyase) katalysiert wird. β-Methylmalyl-CoA wird durch eine Mesaconyl-CoA-Hydratase zu Mesaconyl-C1-CoA umgesetzt.[6] Mesaconyl-C1-CoA entspricht chemisch gesehen 2-Methylfumaryl-CoA. In C. aurantiacus wurde vor kurzem die weitere Reaktionsfolge entschlüsselt.[7] Mesaconyl-C1-CoA wird hierbei zu Mesaconyl-C4-CoA umgewandelt. Diese intramolekulare Umesterung des Coenzym-A wird durch eine Transferase katalysiert. Mesaconyl-C4-CoA wird dann zu (3S)-Citratmalyl-CoA umgeformt, was eine Hydratase katalysiert. Dieses wird schließlich zu Acetyl-CoA und Pyruvat gespalten – durch eine Citratmalyl-CoA-Lyase, den enzymatischen Teil der Malyl-CoA/β-Methylmalyl-CoA/Citratmalyl-CoA-Lyase. Acetyl-CoA wird wie im ersten Teil des 3-Hydroxypropionatzyklus zu Propionyl-CoA aufgebaut. Pyruvat wird dann schließlich über ein Triosephosphat weiter metabolisiert.
Die Bilanz für die Bildung von Pyruvat aus Glyoxylat lautet:
Die Gesamtbilanz zur Bildung eines Moleküls Pyruvat lauft infolgedessen:
Biologische Bedeutung
Die Fixierung von drei Molekülen Bicarbonat zu Pyruvat ist ein insgesamt sehr energieaufwendiger Prozess. Das Aufbauen eines Moleküls Glycerinaldehyd-3-phosphat kostet 10 Äquivalente ATP (das gebildete AMP zählt doppelt). Der Prozess kann aber auch unter aeroben[8] bzw. mikroaerophilen Bedingungen ablaufen, da keine seiner involvierten Enzyme per se sauerstoffempfindlich sind.[2] Neben der Fixierung von Bicarbonat können aber auch Intermediate des Zyklus assimiliert werden (Essigsäure, Propionsäure, C4-Dicarbonsäuren).[9] Diese werden als Gärprodukte von vergesellschafteten Mikroorganismen ausgeschieden.[6]
Eine Besonderheit des Zyklus ist, dass bi- und trifunktionale Enzyme beteiligt sind. So katalysiert die Malonyl-CoA-Reduktase zwei Reaktionsschritte, die Malyl-CoA/β-Methylmalyl-CoA/Citratmalyl-CoA-Lyase und die Propionyl-CoA-Synthase können drei Reaktionen katalysieren. Der gesamte Zyklus erfolgt in 19 Reaktionen, jedoch sind nur 13 Enzyme an den Reaktionen beteiligt.
In einer ähnlichen Form, dem 3-Hydroxypropionat/4-Hydroxybutyratzyklus, wurde die Fixierung Bicarbonats in thermoacidophilen Archaea der Gattungen Metallosphaera, Acidianus und Sulfolobus (alle drei in der Familie Sulfolobaceae, Klasse Thermoprotei) nachgewiesen.[10][11]
Die Verwendung von Bicarbonat anstelle von Kohlenstoffdioxid kann damit erklärt werden, dass C. aurantiacus in Gewässern mit leicht alkalischem Milieu wächst. Unter diesen Bedingungen ist die Konzentration an Bicarbonat höher als die von Kohlenstoffdioxid.
Siehe auch
Weblinks
- Übersicht mit Enzymnamen (auf MetaCyc)
Einzelnachweise
- ↑ Hans Günther Schlegel, Georg Fuchs (Hrsg.): Allgemeine Mikrobiologie. 9. Auflage. Thieme, Stuttgart 2014, ISBN 978-3-13-444609-8, S. 313.
- ↑ a b RK. Thauer: Microbiology. A fifth pathway of carbon fixation. In: Science, 2007, 318 (5857), S. 1782–1783; PMID 18079388; doi:10.1126/science.1152209.
- ↑ H. Holo, R. Sirevåg: Autotrophic growth and CO2 fixation of Chloroflexus aurantiacus. In: Arch. Microbiol., 1986, 145(2), S. 173–180; doi:10.1007/BF00446776.
- ↑ CG. Klatt et al.: Comparative genomics provides evidence for the 3-hydroxypropionate autotrophic pathway in filamentous anoxygenic phototrophic bacteria and in hot spring microbial mats. In: Environ Microbiol., 2007, 9(8), S. 2067–2078; PMID 17635550; doi:10.1111/j.1462-2920.2007.01323.x.
- ↑ RN. Ivanovsky et al.: Evidence for the presence of the reductive pentose phosphate cycle in a filamentous anoxygenic photosynthetic bacterium, Oscillochloris trichoides strain DG-6. In: Microbiology, 1999, 145 (Pt 7), S. 1743–1748; PMID 10439413.
- ↑ a b J. Zarzycki et al.: Mesaconyl-coenzyme A hydratase, a new enzyme of two central carbon metabolic pathways in bacteria. In: J Bacteriol., 2008, 190(4), S. 1366–1374; PMID 18065535; PMC 2238226 (freier Volltext).
- ↑ J. Zarzycki et al.: Identifying the missing steps of the autotrophic 3-hydroxypropionate CO2 fixation cycle in Chloroflexus aurantiacus. In: PNAS USA, 2009, 106(50), S. 21317–21322; PMID 19955419
- ↑ Georg Fuchs (Hrsg.), Hans. G. Schlegel (Autor): Allgemeine Mikrobiologie. Thieme Verlag Stuttgart; 8. Auflage 2007; ISBN 3-13-444608-1; S. 245.
- ↑ G. Fuchs (Hrsg.): Mikrobiologie, S. 249.
- ↑ I. A. Berg et al.: A 3-hydroxypropionate/4-hydroxybutyrate autotrophic carbon dioxide assimilation pathway in Archaea. In: Science, 2007, 318 (5857), S. 1782–1786; PMID 18079405; doi:10.1126/science.1149976.
- ↑ Katharina Munk (Hrsg.): Taschenlehrbuch Biologie: Mikrobiologie. Thieme Verlag, Stuttgart 2008, ISBN 978-3-13-144861-3; S. 412.
Auf dieser Seite verwendete Medien
Autor/Urheber: Yikrazuul, Lizenz: CC BY-SA 3.0
3-Hydroxypropionatzyklus zweiter Teil (Entstehung von Pyruvat)
Autor/Urheber: Yikrazuul, Lizenz: CC BY-SA 3.0
Übersichtsschema des Hydroxypropionatzyklus'
Autor/Urheber: Yikrazuul, Lizenz: CC BY-SA 3.0
3-Hydroxypropionatzyklus (Fixierung von Bicarbonat zu Glyoxylat)


