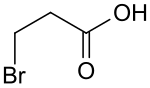
3-Brompropansäure
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 3-Brompropansäure | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C3H5BrO2 | ||||||||||||||||||
| Kurzbeschreibung | geruchloser weißer Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 152,98 g·mol−1 | ||||||||||||||||||
| Aggregatzustand | fest[1] | ||||||||||||||||||
| Dichte | 1,480 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Löslichkeit | löslich in Wasser, Ethanol, Diethylether, Chloroform und Benzol[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
3-Brompropansäure ist eine chemische Verbindung aus der Gruppe der aliphatischen Carbonsäuren mit drei Kohlenstoffatomen, bei denen eines der an einem Kohlenstoffatom gebundenen Wasserstoffatome durch ein Bromatom ersetzt ist. Sie ist damit ein Derivat der Propionsäure.
Gewinnung und Darstellung
3-Brompropansäure kann durch Addition von Bromwasserstoff an Acrylsäure gewonnen werden.[2]
Eine weitere Synthese geht vom 2-Chlorethanol aus, das zunächst mit Natriumcyanid zu 2-Cyanoethanol umgesetzt wird. Dieses reagiert mit Bromwasserstoff und anschließender Hydrolyse zur 3-Brompropansäure.[3][4]
Auch bei der Oxidation von 3-Brompropanal mit Salpetersäure entsteht 3-Brompropansäure.[5]
Eigenschaften
3-Brompropansäure ist ein geruchloser weißer Feststoff, der löslich in Wasser, Ethanol, Ether, Chloroform, Benzol ist.[1]
Durch Zugabe einer etherischen Lösung von 3-Brompropansäure zu einer Lösung von Lithiumaluminiumhydrid-Aluminiumchlorid bei 35 °C kann 3-Brom-1-propanol gewonnen werden.[6]
Im basischen Milieu hydrolysieren die Brompropansäuren, wie die 3-Brompropansäure, zu den entsprechenden Hydroxypropansäuren.[2] Die Verbindung alkyliert Mercaptane und andere schwefelhaltige Verbindungen.[7]
Verwendung
3-Brompropansäure kann als Quaternisierungsmittel in amperometrischen Biosensoren eingesetzt werden.[1] 3-Brompropansäure wird als Zwischenprodukt für die Synthese von Arzneistoffen und Pestiziden verwendet. Sie wird als Alkylierungsmittel für Mercaptane und andere schwefelhaltige Verbindungen verwendet.[8] Sie kann auch anstelle von Iodessigsäure für die Bestimmung von Protein-Thiol-Gruppen verwendet werden.[9]
Sicherheitshinweise
3-Brompropansäure zeigte im Tierversuch tumorerzeugende Wirkung.[1]
Einzelnachweise
- ↑ a b c d e f g h i j k Datenblatt 3-Bromopropionic acid, 97% bei Alfa Aesar, abgerufen am 11. Mai 2022 (Seite nicht mehr abrufbar).
- ↑ a b E. Kowski: "Ueber gebromte Propionsäuren" in Justus Liebigs Annalen der Chemie, 1905, 342 (1), S. 124–138. doi:10.1002/jlac.19053420109
- ↑ E. C. Kendall, B. McKenzie: β-Bromopropionic Acid In: Organic Syntheses. 3, 1923, S. 25, doi:10.15227/orgsyn.003.0025; Coll. Vol. 1, 1941, S. 131 (PDF).
- ↑ E. C. Kendall, B. McKenzie: Ethylene Cyanohydrin In: Organic Syntheses. 3, 1923, S. 57, doi:10.15227/orgsyn.003.0057; Coll. Vol. 1, 1941, S. 256 (PDF).
- ↑ F. Beilstein: Handbuch der organischen Chemie, 3. Auflage, 1. Band. Verlag Leopold Voss, 1893. S. 480. Volltext
- ↑ Robert F. Nystrom: Reduction of Organic Compounds by Mixed Hydrides. III. 3-Bromopropionic Acid, 3-Bromopropionyl Chloride, Methyl 3-Bromopropionate and Halides. In: Journal of the American Chemical Society. Band 81, Nr. 3, 1959, S. 610–612, doi:10.1021/ja01512a026.
- ↑ Datenblatt 3-Brom-propionsäure, 97% bei Sigma-Aldrich, abgerufen am 11. Mai 2022 (PDF).
- ↑ chemicalland21: 3-BROMOPROPIONIC ACID (2-CARBOXYETHYL BROMIDE), abgerufen am 11. Mai 2022
- ↑ A. F. Bradbury, D. G. Smyth: The use of 3-bromopropionic acid for the determination of protein thiol groups. In: Biochemical Journal. Band 131, Nr. 4, 1973, S. 637–642, doi:10.1042/bj1310637, PMID 4737322.
Auf dieser Seite verwendete Medien
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
Autor/Urheber: MegaByte07, Lizenz: CC BY-SA 3.0
Synthesis 3-Bromopropionic acid C
Autor/Urheber: MegaByte07, Lizenz: CC BY-SA 3.0
Synthesis 3-Bromopropionic acid A
Autor/Urheber: MegaByte07, Lizenz: CC BY-SA 3.0
Synthesis 3-Bromopropionic acid B








