2-(4-tert-Butylbenzyl)propionaldehyd
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
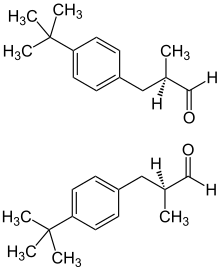 | |||||||||||||||||||
| (R)-Form (oben) und (S)-Form (unten) | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 2-(4-tert-Butylbenzyl)propionaldehyd | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C14H20O | ||||||||||||||||||
| Kurzbeschreibung | farblose Flüssigkeit mit angenehmem Geruch[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 204,31 g·mol−1 | ||||||||||||||||||
| Aggregatzustand | flüssig[2] | ||||||||||||||||||
| Dichte | 0,9408 g·cm−3 (bei 20 °C)[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | 279,5 °C[2] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit | praktisch unlöslich in Wasser (0,033 g·l−1 bei 20 °C)[2] | ||||||||||||||||||
| Brechungsindex | 1,505 (20 °C)[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Zulassungsverfahren unter REACH | besonders besorgniserregend: fortpflanzungsgefährdend (CMR)[5] | ||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
2-(4-tert-Butylbenzyl)propionaldehyd ist ein aromatischer Aldehyd, der in Parfums und Duftstoffen Verwendung findet und nach Maiglöckchen riecht. Da es potentiell allergieauslösend ist, muss es auf Verpackungen von enthaltenden Pflegeprodukten aufgeführt werden, meistens unter dem INCI-Namen Butylphenyl Methylpropional.[6][7] Seit März 2022 ist in der Europäischen Union die Verwendung von 2-(4-tert-Butylbenzyl)propionaldehyd in Kosmetika verboten,[8] da die Substanz – schon im Mai 2020 – als „wahrscheinlich reproduktionstoxisch“ eingestuft worden war.[9]
Eigenschaften
Strukturell leitet sich 2-(4-tert-Butylbenzyl)propionaldehyd vom Bourgeonal ab und besitzt eine zusätzliche Methylgruppe am C-2-Atom. Das Molekül weist eine chirale Struktur mit einem stereogenen Zentrum auf, kommt also in zwei enantiomeren Varianten vor, einem (R)- und einem (S)-Isomer. Die beiden Enantiomere riechen leicht unterschiedlich: das (R)-Isomer duftet eher aldehydisch-chemisch während das (S)-Isomer eher blumig-ölig riecht.[10]
Synthese
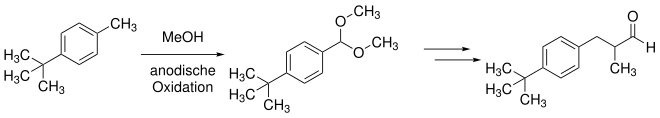
2-(4-tert-Butylbenzyl)propionaldehyd wird großtechnisch von der BASF hergestellt. Im ersten Schritt wird dabei aus 4-tert-Butyltoluol und Methanol (CH3OH) durch doppelte anodische Oxidation ein Acetal hergestellt. Diese geschützte Aldehyd-Funktion kann im Folgenden mit Propanal eine Kondensationsreaktion eingehen. Der finale Schritt ist eine Hydrierungsreaktion.[11]
Umweltrelevanz und Gefahren
Das Scientific Committee on Consumer Safety (SCCS, wissenschaftlicher Ausschuss für Verbrauchersicherheit der EU-Kommission) ist im August 2015 zu dem Schluss gekommen, dass die Nutzung sowohl in abwaschbaren (Rinse-off) als auch in auf der Haut verbleibenden (Leave-on) Kosmetika „nicht sicher“ sei.[12]
2-(4-tert-Butylbenzyl)propionaldehyd wurde 2012 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von 2-(4-tert-Butylbenzyl)propionaldehyd waren die Besorgnisse bezüglich der Einstufung als CMR-Stoff, Verbraucherverwendung und weit verbreiteter Verwendung. Die Neubewertung fand ab 2012 statt und wurde von Schweden durchgeführt. Anschließend wurde ein Abschlussbericht veröffentlicht.[13][14]
Seit März 2022 ist in der Europäischen Union die Verwendung von 2-(4-tert-Butylbenzyl)propionaldehyd in Kosmetika verboten,[15] da die Substanz – schon im Mai 2020 – als „wahrscheinlich reproduktionstoxisch“ eingestuft worden war.[16]
Handelsnamen
2-(4-tert-Butylbenzyl)propionaldehyd wird unter folgenden Handelsnamen vertrieben:
Einzelnachweise
- ↑ Eintrag zu BUTYLPHENYL METHYLPROPIONAL in der CosIng-Datenbank der EU-Kommission, abgerufen am 11. März 2020.
- ↑ a b c d e f g h i Eintrag zu 2-(4-tert-Butylbenzyl)propionaldehyd in der GESTIS-Stoffdatenbank des IFA, abgerufen am 3. Januar 2023. (JavaScript erforderlich)
- ↑ a b c Datenblatt 2-(4-tert-Butylbenzyl)propionaldehyde bei Sigma-Aldrich, abgerufen am 20. Mai 2017 (PDF).
- ↑ Eintrag zu 2-(4-tert-butylbenzyl)propionaldehyde im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 7. Januar 2021. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Eintrag in der SVHC-Liste der Europäischen Chemikalienagentur, abgerufen am 11. Juli 2021.
- ↑ Liste der 26 Allergene in Kosmetika der EU, abgerufen am 9. Mai 2018 (PDF; 11 kB).
- ↑ Verordnung (EG) Nr. 1223/2009 des Europäischen Parlaments und des Rates vom 20. November 2009 über kosmetische Mittel.
- ↑ Verordnung (EU) 2021/1902 der Kommission vom 29. Oktober 2021 zur Änderung der Anhänge II, III und V der Verordnung (EG) Nr. 1223/2009 des Europäischen Parlaments und des Rates hinsichtlich der Verwendung bestimmter als karzinogen, mutagen oder reproduktionstoxisch eingestufter Stoffe in kosmetischen Mitteln, abgerufen am 25. Februar 2022. In: Amtsblatt der Europäischen Union. L, Nr. 387, 3. November 2021, S. 120–125.
- ↑ Rückruf von Stieprox-Shampoo: Duftstoff Lilial ab März in Kosmetik verboten. In: PTAheute. 7. Februar 2022.
- ↑ The Lilials. In: leffingwell.com. John C. Leffingwell, abgerufen am 9. Mai 2018 (englisch).
- ↑ Cian Kingston, Maximilian D. Palkowitz, Yusuke Takahira, Julien C. Vantourout, Byron K. Peters: A Survival Guide for the “Electro-curious”. In: Accounts of Chemical Research. Band 53, Nr. 1, 21. Januar 2020, S. 72–83, doi:10.1021/acs.accounts.9b00539.
- ↑ Scientific Committee on Consumer Safety: OPINION ON Butylphenyl methylpropional (BMHCA). (PDF) 16. März 2016, abgerufen am 1. August 2017 (englisch).
- ↑ Europäische Chemikalienagentur (ECHA): Substance Evaluation Conclusion and Evaluation Report.
- ↑ Community rolling action plan (CoRAP) der Europäischen Chemikalienagentur (ECHA): 2-(4-tert-butylbenzyl)propionaldehyde, abgerufen am 28. November 2023.
- ↑ Verordnung (EU) 2021/1902 der Kommission vom 29. Oktober 2021 zur Änderung der Anhänge II, III und V der Verordnung (EG) Nr. 1223/2009 des Europäischen Parlaments und des Rates hinsichtlich der Verwendung bestimmter als karzinogen, mutagen oder reproduktionstoxisch eingestufter Stoffe in kosmetischen Mitteln, abgerufen am 25. Februar 2022. In: Amtsblatt der Europäischen Union. L, Nr. 387, 3. November 2021, S. 120–125.
- ↑ Rückruf von Stieprox-Shampoo: Duftstoff Lilial ab März in Kosmetik verboten. In: PTAheute. 7. Februar 2022.
Auf dieser Seite verwendete Medien
Globales Harmonisiertes System zur Einstufung und Kennzeichnung von Chemikalien (GHS) Piktogramm für gesundheitsgefährdende Stoffe.
Autor/Urheber: Jü, Lizenz: CC0
(RS)-2-(4-tert-Butylbenzyl)propionaldehyd (±)-2-(4-tert-Butylbenzyl)propionaldehyd
Anodische Oxidation als Syntheseschritt von Lilial




