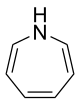
1H-Azepin
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | 1H-Azepin | ||||||||||||
| Andere Namen | Azatropiliden | ||||||||||||
| Summenformel | C6H7N | ||||||||||||
| Kurzbeschreibung | rote Flüssigkeit (bei −78 °C)[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 93,13 g·mol−1 | ||||||||||||
| pKS-Wert | 11,07[2] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Azepin ist eine ungesättigte heterocyclische chemische Verbindung. Es ist der einfachste siebengliedrige ungesättigte stickstoffhaltige Heterocyclus.
Herstellung
Die Synthese von 1H-Azepin kann durch Zersetzung der Azepin-1-carbonsäure erfolgen.[4] Diese ist aus einer der Buchner-Reaktion analogen Ringerweiterung aus Benzol und einem Azidoameisensäureester zugänglich.
Eigenschaften
1H-Azepin liegt im Gleichgewicht mit dem isomeren Aziridin-Derivats des Benzols.[1]
Das Kation des Azepins ist aromatisch, da es ein durchkonjugiertes System aus sechs π-Elektronen besitzt.
1H-Azepin ist bei Raumtemperatur instabil und lagert sich in das stabilere 3H-Azepin um.[1]
Reaktionen
Basen katalysieren die Tautomerisierung von 1H-Azepin zu 3H-Azepin.[4]
Einzelnachweise
- ↑ a b c Eintrag zu Azepine. In: Römpp Online. Georg Thieme Verlag, abgerufen am 28. Dezember 2014.
- ↑ CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, ISBN 0-8493-0303-6.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b E. Vogel, H.-J. Altenbach, J.-M. Drossard, H. Schmickler, H. Stegelmeier: 1H-Azepin: NMR-spektroskopische und chemische Charakterisierung, in: Angew. Chem. 1980, 92, 1053–1054; doi:10.1002/ange.19800921221.
Auf dieser Seite verwendete Medien
Mesomere Grenzstrukturen des Azepinkations.
Syntheseschema von 1H-Azepin
Basen können die Isomerisierung von 1H-Azepin zu 3H-Azepin induzieren.
Schema der Isomerisierung von 1H-Azepin und Aziridinbenzol
Struktur von 1H-Azepin.








