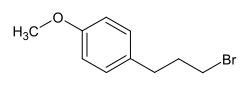
1-(3-Brompropyl)-4-methoxybenzol
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | 1-(3-Brompropyl)-4-methoxybenzol | ||||||||||||
| Andere Namen | 3-(4-Methoxyphenyl)propanylbromid | ||||||||||||
| Summenformel | C10H13BrO | ||||||||||||
| Kurzbeschreibung | farblose Flüssigkeit[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 229,11 g·mol−1 | ||||||||||||
| Aggregatzustand | flüssig[1] | ||||||||||||
| Dichte | 1,311 g·cm−3 (25 °C)[1] | ||||||||||||
| Siedepunkt | |||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||
1-(3-Brompropyl)-4-methoxybenzol ist eine chemische Verbindung, die sich vom Benzol ableitet.
Gewinnung und Darstellung
Eine frühe Synthese wurde 1976 von Walker und Hathway publiziert. Das Edukt Anisaldehyd wird in dieser Synthese im ersten Schritt mit Malonsäure in einer Aldolkondensation umgesetzt. Dabei dient Piperidin als Base. Das entstandene Zimtsäure-Derivat wird dann mit Palladium auf Kohle und Wasserstoff hydriert. Die auf diesem Wege nicht hydrierbare Funktion der Carbonsäure wird im dritten Schritt mit Lithiumaluminiumhydrid zum Alkohol reduziert. Der so entstandene Alkohol wird im letzten Schritt über 5 Stunden langsam zu einer siedenden Lösung von wenig Schwefelsäure in konzentrierter Bromwasserstoffsäure gegeben. Diese Form der Reaktionsführung ist nötig, um die Konkurrenzreaktion der Demethylierung der Methoxygruppe zu verhindern. Dennoch ist die Ausbeute in diesem letzten Schritt am niedrigsten.[2]

Goldup et al. publizierten 2016 eine Synthese, die ebenfalls von einem Naturstoff ausgeht. Das Edukt Estragol wird dabei in Hexan aufgelöst und diese Lösung mit Sauerstoff gesättigt. Dann wird bei 0 °C eine Lösung von Bromwasserstoff in Essigsäure hinzugefügt. Unter diesen Bedingungen (unpolares Lösungsmittel, oxidative Umgebung) findet eine radikalische Addition des Broms an das Alken des Edukts statt, was zum anti-Markownikow-Produkt führt. Das sekundäre Bromalkan (Markownikow-Produkt) entsteht dabei nur zu wenigen Prozent.[3]

Verwendung
1-(3-Brompropyl)-4-methoxybenzol wird in der Supramolekularen Chemie als Edukt für große Ring-Systeme verwendet.[4]
Einzelnachweise
- ↑ a b c d e f Datenblatt 1-(3-Bromopropyl)-4-methoxybenzene bei Sigma-Aldrich, abgerufen am 5. Juli 2022 (PDF).
- ↑ a b G. H. Walker, D. E. Hathway: Synthesis of N-phenyl-2-[1, 4, 5, 8-14C] naphthylamine, N-phenyl-2-[8-13C] naphthylamine, and N-[U-14C] phenyl-2-naphthylamine. In: Journal of Labelled Compounds and Radiopharmaceuticals. Band 12, Nr. 2, 1976, S. 199–206, doi:10.1002/jlcr.2580120206.
- ↑ M. Galli, C. J. Fletcher, M. Del Pozo, S. M. Goldup: Scalable anti-Markovnikov hydrobromination of aliphatic and aromatic olefins. In: Organic & Biomolecular Chemistry. Band 14, Nr. 24, 2016, S. 5622–5626, doi:10.1039/C6OB00692B.
- ↑ J. Winn, A. Pinczewska, S. M. Goldup: Synthesis of a Rotaxane CuI Triazolide under Aqueous Conditions. In: Journal of the American Chemical Society. Band 135, Nr. 36, 2013, S. 13318–13321, doi:10.1021/ja407446c.
Auf dieser Seite verwendete Medien
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
Strukturformel von 1-(3-Brompropyl)-4-methoxybenzol
Synthese von 1-(3-Brompropyl)-4-methoxybenzol nach Walker und Hathway
Synthese von 1-(3-Brompropyl)-4-methoxybenzol nach Goldup et al.





