1,3-Pentadien
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
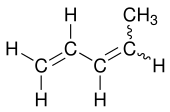 | ||||||||||||||||
| Strukturformel ohne Angabe zur (EZ)-Konfiguration | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | 1,3-Pentadien | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C5H8 | |||||||||||||||
| Kurzbeschreibung | farblose Flüssigkeit[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 68,12 g·mol−1 | |||||||||||||||
| Aggregatzustand | flüssig[1] | |||||||||||||||
| Dichte | 0,68 g·cm−3[1] | |||||||||||||||
| Siedepunkt | 42 °C[1] | |||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
1,3-Pentadien ist eine unpräzise Bezeichnung für zwei chemische Verbindungen aus der Gruppe der Diene, die zueinander isomer (Konfigurationsisomere) sind. Sie werden meist cis- bzw. trans-1,3-Pentadien genannt. Das Isomerengemisch wird auch als Piperylen (abgeleitet von Piperin[4][5]) bezeichnet.
Ein Konstitutionsisomer der 1,3-Pentadiene ist der verzweigte Kohlenwasserstoff 2-Methylbutadien (Isopren).
Geschichte
August Wilhelm Hofmann ließ 1-Methylpiperidin mit Methyliodid zum quartären Ammoniumiodid reagieren und führte die später nach ihm benannte Abbau-Reaktion durch, die Hofmann-Eliminierung. Das gebildete N,N-Dimethylpent-4-enylamin wurde nochmals diesem Abbau unterworfen. Der nach zweimaliger Eliminierung entstehende ungesättigte Kohlenwasserstoff wurde von Hofmann vorläufig als Piperylen bezeichnet; der Name blieb aber noch lange in Gebrauch.[4] Bei der Eliminierung von Trimethylamin aus dem N,N-Dimethylpent-4-enylamin entsteht zunächst 1,4-Pentadien, das aber unter den Reaktionsbedingungen zum 1,3-Pentadien isomeriert.[6]

Isomere
| Isomere von 1,3-Pentadien | |||||||
| Name | trans-1,3-Pentadien | cis-1,3-Pentadien | |||||
| Andere Namen | trans-Penta-1,3-dien (E)-1,3-Pentadien trans-Piperylen (E)-Piperylen | cis-Penta-1,3-dien (Z)-1,3-Pentadien cis-Piperylen (Z)-Piperylen | |||||
| Strukturformel | 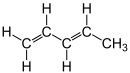 |  | |||||
| CAS-Nummer | 2004-70-8 | 1574-41-0 | |||||
| 504-60-9 (Isomerengemisch) | |||||||
| EG-Nummer | 217-909-5 | 216-401-0 | |||||
| 207-995-2 (unspez.) | |||||||
| ECHA-Infocard | 100.016.282 | 100.014.911 | |||||
| 100.007.269 (unspez.) | |||||||
| PubChem | 62204 | 643785 | |||||
| – (unspez.) | |||||||
| Wikidata | Q126292 | Q27286734 | |||||
| Q72499706 (unspez.) | |||||||
| Schmelzpunkt | −87 °C[7] | −141 °C[8] | |||||
| Siedepunkt | 42 °C[7] | 44 °C[8] | |||||
| Dichte | 0,683 g·cm−3 (25 °C)[7] | 0,691 g·cm−3 (25 °C)[8] | |||||
| Dampfdruck | 452 hPa (20 °C)[7] | 453 hPa (20 °C)[8] | |||||
| Standardbildungsenthalpie | = +18,11 ± 0,16 kcal/mol[9] | = +19,77 ± 0,22 kcal/mol[9] | |||||
| Brechungsindex | 1,430 (20 °C)[7] | 1,437 (20 °C)[8] | |||||
| GHS- Kennzeichnung |
|
| |||||
| H- und P-Sätze | 225‐304‐315‐319‐335 | 225‐304 | |||||
| keine EUH-Sätze | keine EUH-Sätze | ||||||
| 210‐261‐301+310‐305+351+338‐331 | 210‐301+310‐331 | ||||||
Gewinnung und Darstellung
1,3-Pentadien kann durch eine Wittig-Reaktion aus Acetaldehyd, Acrolein oder Crotonaldehyd hergestellt werden, wobei sowohl die Ausbeute als auch die cis/trans-Selektivität in Abhängigkeit von verschiedenen Faktoren (z. B. dem Ausgangsstoff oder dem verwendeten Lösungsmittel) variiert.[10]
Industriell entsteht es als Nebenprodukt des Trennprozesses von rohen C5-Materialien von Pyrolysebenzin (Pygas) – beide Nebenprodukte der Herstellung von Ethylen.[11]
Die Herstellung kann auch durch Methylierung von 1,3-Butadien mit Dimethylsulfoxid in Gegenwart einer Base wie Kalium-tert-butoxid erfolgen, wobei ein Gemisch aus etwa 80 % trans- und 20 % cis-1,3-Pentadien entsteht.[2] Chemiker der Esso Research and Engineering Company in Linden, New Jersey (USA) berichteten über die Methylierung von 1,3-Butadien und anderen ungesättigten Kohlenwasserstoffen mittels Dimethylsulfoxid. Letzteres wird durch starke Basen deprotoniert, wobei das Dimsylat-Anion entsteht. Dieses wird an das konjugierte Dien addiert.[12][13]
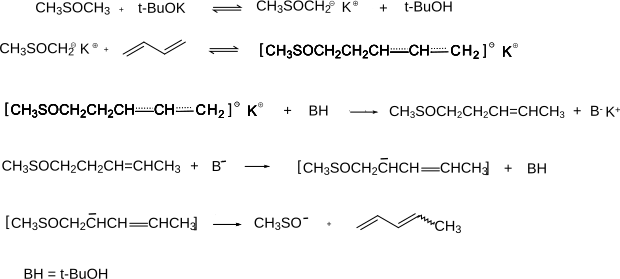
Eigenschaften
Physikalische Eigenschaften
1,3-Pentadien ist eine farblose Flüssigkeit mit Siedepunkt 42–44 °C.[7] Untersuchungen zur Thermodynamik von Pentadienen in der Gasphase ergaben, dass die molaren Bildungsenthalpien von cis- und trans-1,3-Pentadien sich um 6,95 kJ/mol unterscheiden. Danach ist das trans-Isomer etwas stabiler.[9]
Chemische Eigenschaften
Beim Erhitzen von cis-1,3-Pentadien auf ca. 250 °C kann ein Wasserstoffatom der Methylgruppe mit der terminalen Methylidengruppe verknüpft werden. Es handelt sich um ein chemisches Gleichgewicht, das thermische 1,5-Wasserstoffverschiebung, kurz 1,5-H-Verschiebung (engl. 1,5-H-Shift) genannt wird.[14] In diesem Fall ließ es sich nur durch Markierung des Pentadiens mit Deuteriumisotopen nachweisen.[15] Die Reaktion wurde von Robert Burns Woodward und Roald Hoffmann als 1,5-sigmatrope Verschiebung klassifiziert, welche konzertiert und suprafacial erfolgt.[16] Verschiedene quantenchemische Berechnungen haben sich mit dieser Reaktion befasst.[17][18] (Anmerkung: Die o. g. Isomerisierung von 1,4-Pentadien zu 1,3-Pentadien wäre als suprafaciale 1,3-H-Umlagerung konzertiert nicht möglich; offenbar ist diese Reaktion basenkatalysiert).


1,3-Pentadien reagiert mit molekularem Brom zu diastereomeren 1,2,3,4-Tetrabrompentanen. Diese Tetrabromide spielten schon bei A. W. Hofmanns Konstitutionsbestimmung (s. o.) eine Rolle, um nachzuweisen, dass die Verbindung zwei C=C-Doppelbindungen enthält.
Die wichtigste Reaktion des 1,3-Pentadiens dürfte die Polymerisation zu Polypentadienen sein. Wie beim Polybutadien können die Verknüpfungen des Monomers in 1,2- und 1,4-Position („1,2-Addition“ bzw. „1,4-Addition“) stattfinden. Mit Butyllithium initiiert ist eine anionische Kettenpolymerisation möglich.[19]
In Anlehnung an die im Ziegler-Natta-Verfahren verwendeten Katalysatoren wurden mit Cobalt-haltigen Organoaluminium-Verbindungen, die z. B. aus Diethylaluminiumchlorid (AlEt2Cl), oder Triethyl-dialuminiumtrichlorid (Al2Et3Cl3) hergestellt wurden, Katalysatoren entwickelt, mit denen Polymere verschiedener Struktur und Eigenschaften erhalten werden. Kristalline Polymere bestehen aus cis-1,4-syndiotaktischen Strukturelementen, amorphe Polymere sind aus cis-1,4- und 1,2-Einheiten zusammengesetzt. Schwach kristalline Polymere haben eine 1,2-syndiotaktische Struktur.[20] Mit einem ähnlichen Cobalt-Katalysator wurde trans-1,2-Poly-1,3-pentadien hergestellt.[21]
Verwendung
1,3-Pentadien, b. z. w. Piperylen dient in erster Linie als Monomer bei der Herstellung von Kunststoffen, Klebstoffen und Harzen. Piperylen-basierte Produkte werden insbesondere in modernen Klebstoffen – wie bei der Herstellung von Briefumschlägen, Paketband und Windelbefestigungen – sowie weltweit in Fahrbahnmarkierungen verwendet. Außerdem wird 1,3-Pentadien zur Herstellung anderer chemischer Verbindungen wie z. B. 2-Methylfuran verwendet.[11]
Literatur
- Arno Behr, Peter Neubert: Piperylene — A Versatile Basic Chemical in Catalysis. In: ChemCatChem, 6, 2013, S. 1867–3880. doi:10.1002/cctc.201300523.
Einzelnachweise
- ↑ a b c d e f g Eintrag zu P1841 1,3-Pentadiene (cis- and trans- mixture) (stabilized with TBC), >96.0% bei TCI Europe, abgerufen am 7. November 2022.
- ↑ a b Eintrag zu trans-1,3-Pentadiene in der Hazardous Substances Data Bank (via PubChem), abgerufen am 13. Oktober 2012.
- ↑ Registrierungsdossier zu Penta-1,3-diene (Abschnitt GHS) bei der Europäischen Chemikalienagentur (ECHA), abgerufen am 25. April 2022.
- ↑ a b A. W. Hofmann: Einwirkung der Wärme auf die Ammoniumbasen. In: Berichte der deutschen chemischen Gesellschaft. 14, 1881, S. 659–669. doi:10.1002/cber.188101401148.
- ↑ C. Schotten: Beitrag zur Kenntniss des Piperidins. In: Berichte der deutschen chemischen Gesellschaft 15, 1882, S. 421–427, doi:10.1002/cber.18820150186.
- ↑ Albert Gossauer: Struktur und Reaktivität der Biomoleküle. John Wiley & Sons, 2003, ISBN 3-906390-29-2, S. 255 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b c d e f g Datenblatt trans-1,3-Pentadiene, 90% bei Sigma-Aldrich, abgerufen am 13. Oktober 2012 (PDF).
- ↑ a b c d e f Datenblatt cis-1,3-Pentadiene, 98% bei Sigma-Aldrich, abgerufen am 13. Oktober 2012 (PDF).
- ↑ a b c Frances Maron, J. Prosen: Heats of Combustion and Isomerization of Six Pentadienes and Spiropentane. In: Journal of Research of the National Bureau of Standards. 54, 1955, Research Paper No. 2575.
- ↑ Jerome Thomas Kresse: The investigation of factors influencing the stereochemistry of the Wittig reaction (PDF; 3,9 MB), University of Florida, Diss., 1965.
- ↑ a b Shell Chemicals:Piperylene product overview ( vom 18. September 2013 im Internet Archive).
- ↑ P. A. Argabright, J. E. Hofmann, A. Schriesheim: Methylation of Simple Unsaturated Hydrocarbons by Dimethyl Sulfoxide. In: The Journal of Organic Chemistry. 30, 1965, S. 3233–3235. doi:10.1021/jo01020a525.
- ↑ Herman Pines: Base-Catalyzed Carbon-Carbon Addition of Hydrocarbons and of Related Compounds. In: Accounts of Chemical Research. 7, 1974, S. 155–162. doi:10.1021/ar50077a005.
- ↑ Übersicht: V. A. Mironov, A. D. Fedorovich, A. A. Akhrem: The 1,5-Shift Reaction. In: Russian Chemical Reviews. 50, 1981, S. 666–677. Russisches Original: Uspekhi Khimii. 50, 1981, S. 1272–1303.
- ↑ W. R. Roth, J. König: Kinetischer Isotopeneffekt der 1.5-Wasserstoffverschiebung im cis-Pentadien-(1.3). In: Justus Liebigs Annalen der Chemie. 699, 1966, S. 24. doi:10.1002/jlac.19666990103.
- ↑ R. B. Woodward, R. Hoffmann: Die Erhaltung der Orbitalsymmetrie, S. 114 und 123. Verlag Chemie, Weinheim, 1970.
- ↑ B. A. Heß, L. J. Schaad: Ab initio study of the transition structure of the [1,5]-sigmatropic hydrogen transfer in cis-1,3-pentadiene. In: Journal of the American Chemical Society 105, 1983, S. 7185–7186. doi:10.1021/ja00362a035.
- ↑ Kendall N. Houk, Yi Li, Jeffrey D. Evanseck: Übergangsstrukturen in pericyclischen Reaktionen von Kohlenwasserstoffen. In: Angewandte Chemie, 104, 1992, S. 711–739. doi:10.1002/ange.19921040606.
- ↑ US-Patent 4486614-A für Dow Chemicals Co. vom 4. 12. 1984, Erfinder Felipe A. Donate, John W. Bozzelli, Kent S. Dennis.
- ↑ L. Porri, A. di Corato, G. Natta: Polymerization of 1,3-pentadiene by cobalt catalysts. Synthesis of 1,2 and cis-1,4 syndiotactic polypentadienes. In: European Polymer Journal. 5, 1969, S. 1–13. doi:10.1016/0014-3057(69)90097-4.
- ↑ US-Patent 3824226-A vom 16.07.1974 für Bayer AG: Process for the production of trans-1,2-poly-1,3-pentadiene, Erfinder G. Marwede, G. Pampus, F. Haas, P. Gunther, W. Oberkirch, Priorität vom 28.03.1970. A Catalyst system for the stereospecific polymerisation of 1,3-pentadiene into trans-1,2-poly-1,3-pentadiene, comprisimg (A) an anhydrous cobalt salt (B) an acid amide or an ether and (C) an organoaluminium compound and a process for polymerising 1,3-pentadiene in an inert solvent at temperatures of from -50° to +100 °C. Using the catalyst.
Auf dieser Seite verwendete Medien
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for flammable substances
Globales Harmonisiertes System zur Einstufung und Kennzeichnung von Chemikalien (GHS) Piktogramm für gesundheitsgefährdende Stoffe.
Skelettformeln der 1,5-Wasserstoff-Verschiebung im cis-1,3-Pentadien
Formelschema der Bildung des Kohlenwasserstoffs Piperylen (1,3-Pentadien) nach Hofmann
Formelschema der 1,5-sigmatropen Wasserstoff-Verschiebung im cis-1,3-Pentadien
Strukturformel von cis-1,3-Pentadien / (Z)-1,3-Pentadien
Formelschema der Methylierung von 1,3- Butadien mittels Dimethylsulfoxid und Kalium tert.-Butanolat
Autor/Urheber: Gimli21, Lizenz: CC BY-SA 4.0
1,3-Pentadiene without specific E/Z-configuration











