Östliche Braunschlange
| Östliche Braunschlange | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
 Östliche Braunschlange (Pseudonaja textilis) | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Pseudonaja textilis | ||||||||||||
| (Duméril, Bibron & Duméril, 1854) |
Die Östliche Braunschlange (Pseudonaja textilis), auch Gewöhnliche Braunschlange oder Östliche Braunotter, ist eine in Australien und Neuguinea vorkommende Giftnatter aus der Gattung der Braunschlangen (Pseudonaja).
Vorkommen
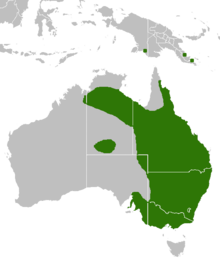
Sie ist im östlichen Australien verbreitet und dort in New South Wales, Queensland, den Northern Territories, Südaustralien und Victoria anzutreffen. Des Weiteren bevölkert die Giftschlange das nördlich von Australien gelegene Neuguinea.[1]
Diese Art bewohnt eine Vielzahl von Lebensräumen, darunter feuchte und trockene Hartlaubwälder, Heideland an der Küste, Savannenwälder, Grasland und trockenes Gestrüpp. Auch in landwirtschaftlichen Regionen (einschließlich Palmölplantagen) und in der Peripherie fast aller ostaustralischen Ortschaften ist sie zu finden.[2] Besiedelte Biotope zeichnen sich oftmals durch Trockenheit aus, aber auch feuchte Biotope werden nicht gemieden. Als Verstecke dienen Baumstämme, Steinhaufen oder -platten oder Erdlöcher, einschließlich Kaninchenbauten.[3]
Die IUCN stuft die Art als nicht gefährdet (least concern) ein.[2]
Merkmale
Die Östliche Braunschlange besitzt einen schlanken Körperbau und erreicht eine Gesamtlänge von etwa 150 cm.[3] Einige Individuen erreichen jedoch nachweislich eine Länge von bis zu 2,4 m.[4] Der rundliche[4] Kopf setzte sich kaum vom Hals ab. Das Auge ist groß, die Pupillen verengen sich bei Lichteinfall rundlich. Es sind sechs Unterlippenschilde und sechs Oberlippenschilde vorhanden. Der Körper wird oberseits von 17 Reihen glatter Dorsalschuppen bedeckt. Unterseits zeigen sich 185 bis 235 Ventralschilde sowie 45 bis 75 paarige Unterschwanzschilde. Die Östliche Braunschlange besitzt 38 Chromosomenpaare und unterscheidet sich hiermit von einigen anderen Pseudonaja-Arten.[3]
Die Körperfärbung adulter Tiere variiert. Die Grundfärbung reicht von beige über grau und braun bis schwarz. Dabei können die Tiere einfarbig oder schwarz gesprenkelt sein, selten finden sich auch adulte Tiere mit leichter, dunkler Bänderung. Die Bauchseite ist cremefarben oder hellbraun und kann orange, grau oder braun gesprenkelt sein. Jungtiere weisen ein deutliches Muster schwarzer Querbänder auf Körper und Schwanz auf, der Kopf ist oberseits schwarz gefärbt. Diese Jugendzeichnung verblasst mit dem Heranwachsen und verschwindet für gewöhnlich vollständig.[3]

Lebensweise
Die Östliche Braunschlange führt eine weitgehend tagaktive Lebensweise. Beutetiere werden durch Giftbiss immobilisiert, gleichzeitig jedoch umschlungen und erdrosselt. Zum Beutespektrum zählen Kleinsäuger, Vögel, Froschlurche, Eidechsen und andere Schlangen. Die Fortpflanzung erfolgt durch Oviparie, also eierlegend. Die Paarungszeit fällt in die Monate Oktober und November. Ein Gelege kann zwischen 20 und 30 Eier umfassen. Nach circa 60 Tagen schlüpfen die zwischen 17 und 20 cm großen Jungschlangen.[3] Bei Bedrohung legt die Östliche Braunschlange ein auffälliges Abwehrverhalten an den Tag. Die Art gilt als sehr gefährlich, da sie bei Begegnungen nervös und aggressiv reagieren kann. Dabei windet sie ihren Körper zu einer S-Form und beißt dann extrem schnell und meist mehrfach (vier- bis fünfmal) zu.[4]
Schlangengift
Das Giftsekret der Östlichen Braunschlange ist extrem wirksam – der LD50-Wert für Mäuse liegt bei 0,05 bis 0,06 mg pro Kilogramm Körpergewicht, womit es zu den wirksamsten Giften gehört, die bei Schlangen bekannt sind. Besonders in der Populärliteratur wird sie häufig als zweitgiftigste Schlangenart nach dem Inlandtaipan beschrieben.[4] Maßgeblich an der Giftwirkung beteiligt sind Bestandteile mit Einfluss auf die Blutgerinnung. Dies umfasst vor allem das Protein Textilinin, das sich vom lateinischen Namen der Schlange ableitet. Dieser Bestandteil aktiviert das Prothrombin und wandelt es in Thrombin um, es kommt also zu einer Aktivierung der Blutgerinnung. Es stellt sich eine so genannte Verbrauchskoagulopathie ein, da alle Gerinnungsfaktoren so stark verbraucht werden, dass das Blut danach beinahe ungerinnbar ist. Des Weiteren hemmt es das Protein Plasmin und verhindert damit das Auflösen der Blutgerinnsel.[4] Weiterhin verfügt das Toxingemisch über neurotoxische Komponenten. Als präsynaptisch wirksames Neurotoxin ist im Giftsekret der Art Textilotoxin enthalten, ein Phospholipase A2-Enzym mit vier Untereinheiten.[5] Es bewirkt, dass die Freisetzung von Acetylcholin, welches einen wichtigen Neurotransmitter darstellt, komplett eingestellt wird. Dies führt von einer Störung bis zur Hemmung der elektrischen Reizausbreitung von den Nerven zu den Muskeln, mit der Folge einer neuromuskulären Blockade (Muskellähmung).[4]
Toxikologie
Klinisch zeigen sich nach Giftbiss Zeichen einer beginnenden Atemlähmung und rasch einsetzende starke Blutungen, labordiagnostisch sind Thrombozytopenie, erhöhte Prothrombinzeit und verringerte Fibrinogenwerte feststellbar. Sekundär kann sich durch auftretende Mikrogerinnsel ein akutes Nierenversagen mit Anurie einstellen. Die Ausbildung eines Lungenödems wurde ebenfalls dokumentiert.[5]
Nach einem Giftbiss beim Menschen ist das Anlegen eines Kompressionsverbands eine wichtige Erste-Hilfe-Maßnahme, um die Ausbreitung von der Bissstelle zu verzögern. Von Reinigung, Desinfektion oder sonstiger Manipulation der Bissstelle sollte abgesehen werden. In Australien kommt es durchaus vor, dass man Giftrückstände an der Bissstelle biochemisch nachweist, um Diagnostik und Therapieentscheidungen zu unterstützen. Durch etwaige Manipulationen würde man diese Rückstände entfernen. Infusionen von Blutplasma und Thrombozytenkonzentrat können zur Korrektur der Gerinnungswerte eingesetzt werden. Wichtigste therapeutische Maßnahme ist jedoch die schnellstmögliche Verabreichung eines geeigneten Antivenins, sofern Anzeichen einer Vergiftung (z. B. Lähmungserscheinungen wie Ptosis oder auffällige Gerinnungsparameter) vorliegen. Es stehen Brown Snake Antivenom sowie Polyvalent Snake Antivenom (Australia – New Guinea) CSL zur Verfügung. Unter Umständen müssen mehrere Dosen Antiserum verabreicht werden.[5]
Fallbeschreibung
Mebs (2010) liefert die Fallbeschreibung eines 39-Jährigen Mannes, der in Hand und Fuß gebissen wurde, nachdem er eine Östliche Braunschlange nachhaltig provoziert hatte. Das Tier verbiss sich in der Hand des Betroffenen. Innerhalb von zehn Minuten setzte Bewusstlosigkeit ein, nach 15 Minuten traf der Patient im Krankenhaus ein. Es zeigte sich das Vollbild der obig beschriebenen Symptomatik und der Patient musste intubiert werden. Initial wurde je eine Ampulle monovalentes und eine Ampulle polyvalentes Antivenin verabreicht. Hämodialyse und die Applikation zahlreicher Einheiten Blutplasma, Kryopräzipitat und Thrombozytenkonzentrat wurden ebenfalls durchgeführt und 8 Stunden nach dem Biss besserten sich die Gerinnungsparameter. Nach weiteren 4 Stunden kam es zu einem plötzlichen Blutdruckabfall. Es wurden weitere Antiserumdosen verabreicht. Dennoch verstarb der Patient 17 Stunden nach dem Bissunfall. Als Todesursache wurde Herzversagen angegeben, das möglicherweise auf Mikrogerinnsel in den Kapillaren der Koronargefäße zurückzuführen war.[5]
Taxonomie
Die Art wurde 1854 von André Duméril, Gabriel Bibron und Auguste Duméril unter dem Taxon Furina textilis erstbeschrieben. Es werden keine Unterarten unterschieden.[1]
Weblinks
- Pseudonaja textilis In: The Reptile Database
- Pseudonaja textilis in der Roten Liste gefährdeter Arten der IUCN 2018. Eingestellt von: Tallowin, O., O’Shea, M., Parker, F., Greenlees, M. & Shea, G., 2017. Abgerufen am 14. Oktober 2021.
Einzelnachweise
- ↑ a b Pseudonaja textilis In: The Reptile Database; abgerufen am 2. Oktober 2021.
- ↑ a b Pseudonaja textilis in der Roten Liste gefährdeter Arten der IUCN 2018. Eingestellt von: Tallowin, O., O’Shea, M., Parker, F., Greenlees, M. & Shea, G., 2017. Abgerufen am 14. Oktober 2021.
- ↑ a b c d e Trutnau, L. (1998): Schlangen im Terrarium - Bd. 2: Giftschlangen, Verl. Eugen Ulmer.
- ↑ a b c d e f Östliche Braunschlange auf Goruma, aufgerufen am 19. Oktober 2024
- ↑ a b c d Mebs, D.: Gifttiere. Ein Handbuch für Ärzte, Biologen und Apotheker. Wissenschaftliche Verlagsgesellschaft, 3. Auflage, 2010.
Auf dieser Seite verwendete Medien
Autor/Urheber: Matt from Melbourne, Australia, Lizenz: CC BY 2.0
Northern Victoria. Australia. (Pseudonaja textilis VS Tiliqua scincoides scincoides)
Autor/Urheber: Matt from Melbourne, Australia, Lizenz: CC BY 2.0
South-west Melbourne area.
Autor/Urheber: Casliber, Lizenz: CC BY-SA 4.0
Range map of eastern brown snake (Pseudonaja textilis). Base map is File:Australia blank map in grayscale.png. Information on Australian range is from IUCN page. New Guinea items from this paper.


