Gleichverteilungssatz
Der Gleichverteilungssatz (auch Äquipartitionstheorem genannt) ist ein Satz aus der statistischen Physik, der einen Zusammenhang zwischen dem Mittelwert der Energie eines Systems im thermischen Gleichgewicht und seiner Temperatur herstellt. Seine Kernaussage ist, dass im thermischen Gleichgewicht jeder Freiheitsgrad des Systems die gleiche mittlere Energie besitzt, unabhängig von den Massen und anderen Eigenschaften der Teilchen und von der Zusammensetzung des Systems.
Die Gleichverteilung der kinetischen Energie zeigt sich dementsprechend auch z. B. in Gasgemischen, bei freien Neutronen in einem Moderator oder im Plasma eines Fusionsreaktors.
Der Gleichverteilungssatz gilt nur für Freiheitsgrade, die im thermischen Gleichgewicht tatsächlich angeregt werden, also nicht „eingefroren“ sind. Beispielsweise sind Molekülschwingungen von Molekülen wie H2 oder O2 bei Raumtemperatur nicht angeregt, weil die für den Übergang auf angeregte Zustände nötige Energie nicht erreicht wird.
Freiheitsgrade, deren Variablen nicht in der Hamilton-Funktion vorkommen, führen auch nicht zu einem Beitrag zur Energie.
Der Gleichverteilungssatz ist ein streng gültiges Resultat der klassischen statistischen Mechanik und gilt auch für relativistische Energien. Er gilt aber wegen der Möglichkeit des Einfrierens der Freiheitsgrade im Rahmen der Quantenstatistik nur bei genügend hoher Temperatur. Dies führt dazu, dass der Gleichverteilungssatz auch für manche klassischen Probleme der klassischen Physik ungültig ist, namentlich bei der Ultraviolettkatastrophe und bei Abweichungen der spezifischen Wärmekapazität von Festkörpern vom Dulong-Petit-Gesetz.
Geschichte
Erste Formulierungen
Erste Überlegungen, die Aussagen des Gleichverteilungssatzes enthalten, wurden vom schottischen Physiker John James Waterston im Rahmen seiner Untersuchung der kinetischen Gastheorie angegeben. Waterston stellte fest, dass das thermische Gleichgewicht erreicht ist, wenn die vis viva, eine historische Bezeichnung für das Doppelte der kinetischen Energie, jedes Teilchens gleich ist.[1] Da die kinetische Gastheorie zu diesem Zeitpunkt noch nicht etabliert war, gerieten seine Ergebnisse in Vergessenheit.
James Clerk Maxwell stellte 1878 fest, dass bei gegebener Temperatur die gesamte kinetische Energie eines Systems das Produkt der Freiheitsgrade eines Systems mit einer universellen Konstanten sein müsse.[2] Dadurch konnte er das bereits seit 1819 experimentell bekannte Dulong-Petit-Gesetz theoretisch erklären. Weitere Bestätigungen erhielt der Gleichverteilungssatz durch die Messungen der spezifischen Wärmekapazität von Edel- und anderen einatomigen Gasen, wie zum Beispiel Quecksilberdampf.
Probleme des Gleichverteilungssatzes
Trotz dieser Erfolge versagte das Dulong-Petit-Gesetz insbesondere bei der spezifischen Wärmekapazität von Diamanten. Weitere Untersuchungen von Heinrich Friedrich Weber über die Wärmekapazität von Kohlenstoff, Bor und Silizium ergaben, dass das Dulong-Petit-Gesetz und somit auch der Gleichverteilungssatz nur für genügend hohe Temperaturen gültig sind.[3] Diese Abweichungen vom Dulong-Petit-Gesetz konnten erstmals durch das von Albert Einstein aufgestellte Einstein-Modell, das die Quantenmechanik berücksichtigt, erklärt werden.
Darüber hinaus fand Arnold Eucken durch Messungen an Wasserstoffgas heraus, dass dessen Wärmekapazität bei Abkühlung von ungefähr 5 cal/(mol K) bei Raumtemperatur auf 3,3 cal/(mol K) bei 60 K fällt, um daraufhin ungefähr konstant zu bleiben. Dies ist der Wert, der vom Gleichverteilungssatz für einatomige Gase vorhergesagt wird; für zweiatomige indes sagt er eine Wärmekapazität von 7 cal/(mol K) vorher. Eucken stellte fest, dass seine Messungen an Wasserstoff mit den Vorhersagen des Einstein-Modells nicht in Einklang zu bringen waren.[4] Erst weitere Erkenntnisse der Quantenmechanik konnten erklären, dass bei tiefen Temperaturen manche Freiheitsgrade in mehratomigen Gasen nicht angeregt werden.
Die berühmteste fehlerhafte Vorhersage des Gleichverteilungssatzes wird als Ultraviolettkatastrophe bezeichnet. Sie folgt zwingend aus der Annahme der universellen Gültigkeit des Rayleigh-Jeans-Gesetzes für die Energiedichte der Strahlung eines Schwarzen Strahlers: Nach dem Gleichverteilungssatz müsste jede Schwingungsmode dieselbe Energie besitzen; dies führt dazu, dass die spektrale Energiedichte durch den Beitrag der kleinen Wellenlängen beliebig groß wird. Auch dieses Problem kann durch die Einbeziehung der Quantenmechanik gelöst werden, wie Max Planck 1900 mit seinem Strahlungsgesetz gezeigt hatte.
Abschließend zum Verhältnis zwischen der Quantenmechanik und dem Gleichverteilungssatz konnte Einstein 1924 bei der Untersuchung von Bosegasen zeigen, dass der Gleichverteilungssatz gültig ist, wenn die Teilchendichte genügend klein und die Temperaturen genügend hoch sind, also genau dann, wenn der klassische Limes gebildet werden kann.[5]
Mathematische Formulierung
Aussage
Die allgemeinste Aussage des Gleichverteilungssatzes lautet
mit
- dem Ensemblemittelwert
- der Hamilton-Funktion des Systems
- der Temperatur des Systems
- der Boltzmann-Konstanten
- dem Kronecker-Delta
- den Phasenraum-Koordinaten
Die Phasenraum-Koordinaten sind dabei die Impulse oder die Orte . Daher kann mithilfe der Hamiltonschen Bewegungsgleichungen explizit für die Orte und Impulse der Gleichverteilungssatz alternativ als
respektive
dargestellt werden, wobei ein Punkt über den Variablen die totale zeitliche Ableitung bezeichnet.
Speziell nützlich ist der Gleichverteilungssatz, wenn die Hamiltonfunktion in einzelne Summanden zerfällt, die nur von jeweils einem einzigen Freiheitsgrad abhängen und alle diese Freiheitsgrade in identischer Potenz auftreten, das heißt, wenn
mit Konstanten ist. Dann gilt:
Da alle Phasenraumvariablen unabhängig und somit unkorreliert sind, ist Daher gilt
oder auch
- .
Die an die Hamiltonfunktion gestellte Bedingung gilt insbesondere für die kinetische Energie eines Systems aus freien Teilchen, in die nur die Impulskomponenten quadratisch eingehen (), und für Teilchen in einem harmonischen Potential, in das zusätzlich die Ortskomponenten quadratisch eingehen.
Generell gilt diese Aussage auch für allgemeinere Hamiltonfunktionen der Form
- .
Herleitung aus der statistischen Mechanik
Ausgangspunkt der Herleitung des Gleichverteilungssatzes ist ein abgeschlossenes System, das energetisch an ein Wärmebad gekoppelt ist. Es bietet sich daher die Betrachtung des kanonischen Ensembles an. Dann gilt mit der Definition des Ensemblemittelwerts:
Die Integration erfolgt über den gesamten zugänglichen Phasenraum . bezeichnet die inverse Temperatur und die kanonische Zustandssumme. Partielle Integration führt auf
wobei der Randterm durch das Exponential der Hamiltonfunktion schnell genug abfällt, sodass dieser verschwindet. Es bleibt:
Die Herleitung wurde hier mit Hilfe des kanonischen Ensembles durchgeführt, sie ist auch mittels mikrokanonischen Ensembles möglich. Der Gleichverteilungssatz kann nicht im großkanonischen Ensemble hergeleitet werden, jedoch sind für große Teilchenzahlen alle Ensembles äquivalent, sodass er auch für offene Systeme gilt.
Herleitung für ideale Gase aus der kinetischen Gastheorie
Für ein ideales Gas, dessen Hamiltonfunktion nur den kinetischen Anteil enthält, lässt sich der Gleichverteilungssatz mithilfe der Maxwell-Boltzmann-Verteilung herleiten. Diese Verteilung gibt die Wahrscheinlichkeitsdichte an, mit der ein Teilchen eine bestimmte Geschwindigkeit besitzt und lautet:
Mit der Hamiltonfunktion lässt sich somit deren Erwartungswert als Erwartungswert des Geschwindigkeitsquadrats ausrechnen. Es gilt:
Zusammenhang mit dem Virialsatz
Der Virialsatz stellt einen Zusammenhang zwischen dem zeitlichen Mittelwert der kinetischen Energie und dem Potential eines Systems her. Er lautet mit der Kraft auf jedes Teilchen
wobei die Summe über alle Teilchen eines Systems läuft und der Überstrich das Zeitmittel symbolisiert.
Für konservative Kräfte kann aus dem Gleichverteilungssatz eine Aussage abgeleitet werden, die dem Virialsatz ähnelt, aber das Zeitmittel durch das Ensemblemittel ersetzt. Für konservative Kräfte ist der Impuls ein Monom in der Hamiltonfunktion und es gilt
wobei die -te Impulskomponente des -ten Teilchens ist. Andererseits ist
für jedes . Daher gilt
und somit:
Allgemein besagt die Ergodenhypothese, dass in ergodischen Systemen Zeitmittel und Ensemblemittel übereinstimmen. Umgekehrt kann gezeigt werden, dass auf die Ergodizität des Systems für eine Herleitung des Gleichverteilungssatzes im mikrokanonischen Ensemble, wenn ein System nicht mit seiner Umgebung wechselwirkt, nicht verzichtet werden kann.
Anwendungen
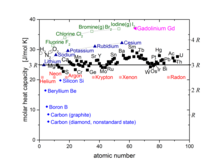
Wärmekapazität von Festkörpern, Dulong-Petit-Gesetz
Bei Festkörpern kann die Schwingung der Atome um ihre Ruheposition durch das Potential eines harmonischen Oszillators angenähert werden. Je Raumrichtung ist die dazugehörige Energie durch
gegeben, wobei die Kreisfrequenz des Oszillators ist und die Auslenkung des Atoms aus seiner Ruhelage in Richtung bedeutet. (Es können die einzelnen Atome dabei auch verschiedene Frequenzen haben.) Der erste Summand ist die kinetische Energie, der zweite die potentielle Energie. Es kommen also zwei Freiheitsgrade pro Atom und Raumdimension als Quadrat vor, in drei Dimensionen also sechs Freiheitsgrade je Atom. Daher ist die mittlere Energie je Atom
Bei Atomen ( ist die Avogadro-Konstante) sind also Freiheitsgrade zu berücksichtigen. Daraus ergibt sich unmittelbar die molare Wärmekapazität von
Diese Gleichung ist als Dulong-Petit-Gesetz bekannt. Abweichungen, wie sie schon bei normaler Temperatur bei Bor, Kohlenstoff und Silizium beobachtet wurden, können nur durch die Quantenmechanik verstanden werden. Die Abweichungen ergeben sich dadurch, dass nicht alle Freiheitsgrade angeregt werden, wenn die Temperatur nicht genügend hoch ist. Quantenphysikalische Modelle zur Berechnung der Wärmekapazität sind das Einstein-Modell von 1907 und das entscheidend verbesserte Debye-Modell von 1912. Sie enthalten das Dulong-Petit-Gesetz als Grenzfall bei hohen Temperaturen.
Wärmekapazitäten idealer Gase
Einatomiges ideales Gas
Für Teilchen, die miteinander nur durch harte elastische Stöße wechselwirken (einatomiges ideales Gas), in drei Raumdimensionen besteht die Hamiltonfunktion nur aus dem kinetischen Anteil:
Die Anwendung des obigen Ergebnisses
liefert:
Das heißt, pro Translationsfreiheitsgrad (hier ) ist die mittlere kinetische Energie . Seine molare Wärmekapazität ist entsprechend
was auch gut mit der gemessenen Wärmekapazitäten für die Edelgase (im obigen Diagramm rot) übereinstimmt.
Zweiatomiges ideales Gas
Für ein zweiatomiges ideales Gas – die einzelnen Moleküle wechselwirken nur durch harte elastische Stöße miteinander und können nicht um die Molekülachse rotieren – lautet die Hamiltonfunktion bei konstantem Trägheitsmoment (d. h. unter Vernachlässigung der Rotations-Vibrations-Kopplung)
wobei die Gesamtmasse, die reduzierte Masse und das Trägheitsmoment eines Moleküls ist. beschreibt die Auslenkung aus dem Gleichgewichtsabstand. Insgesamt gehen also sieben Größen quadratisch in die Hamiltonfunktion ein: . Daraus folgt:
und
- .
In der Praxis misst man für die meisten zweiatomigen realen Gase nur eine Wechselwirkung von ungefähr . Dies liegt daran, dass die Vibrationsfreiheitsgrade bei Raumtemperatur meist nicht angeregt werden. Je schwächer die Bindung zwischen den Atomen wird, desto eher findet dieser Vorgang statt und Vibrationsfreiheitsgrade führen zu einem Beitrag in der Wärmakapazität, wie am obigen Diagramm für die Halogene (in grün) ersichtlich wird.
Relativistisches ideales Gas
In der speziellen Relativitätstheorie lautet die Hamiltonfunktion des idealen Gases
- ,
wobei die Lichtgeschwindigkeit ist. Insbesondere lässt sich auf eine Hamiltonfunktion dieser Gestalt nicht direkt die vereinfachte Form des Gleichverteilungssatzes anwenden, um einen Zusammenhang zwischen dem Erwartungswert der Hamiltonfunktion und der Temperatur des Gases herzustellen. Für den hochrelativistischen Limes, also im Fall hoher Teilchenenergien , kann die Hamiltonfunktion jedoch als
genähert werden. Daraus folgt, dass im relativistischen Limes der Gleichverteilungssatz
liefert. Entsprechend erhöht sich die spezifische Wärmekapazität für hochrelativistische Gase auf
- .
Thermische Zustandsgleichung realer Gase
Für ein reales Gas in einem Behälter lautet die Hamiltonfunktion
- ;
ist das Potential zwischen Wand und Teilchen, das Potential zwischen den Teilchen. Für einen würfelförmigen Behälter mit Seitenlänge schreibt sich das Wandpotential z. B. wie folgt:
Dabei wurde die Heaviside-Funktion verwendet. Die Anwendung des Virialsatzes (im Sinne der Quantenmechanik) liefert:
Der erste Term auf der rechten Seite ist
- .
Es wurde ausgenutzt, dass die distributive Ableitung der Heaviside-Funktion die Delta-Distribution ist. ist das Volumen, . Da der Druck definiert ist durch (siehe z. B. Kanonisches Ensemble), ergibt die Ensemblemittelung
- .
Somit erhält man die thermische Zustandsgleichung:
Diese entspricht der idealen Gasgleichung, die um einen Zusatzterm – das Virial – erweitert ist. Das Virial kann in Potenzen der Teilchendichte entwickelt werden (siehe: Virialentwicklung).
Gegenbeispiel: Quantenmechanischer harmonischer Oszillator
Ein eindimensionaler quantenmechanischer harmonischer Oszillator hat den Hamiltonoperator
- .
Mit dem Besetzungszahloperator und dem reduzierten Planckschen Wirkungsquantum kann man ihn als
umschreiben. Der Energieerwartungswert ergibt sich aus der Quantenstatistik (mit der inversen Temperatur ) zu
Für kleine Temperaturen, also , ist ; nur für genügend hohe Temperaturen mit gilt der klassische Gleichverteilungssatz .
Einzelnachweise
- ↑ Clifford Truesdell: Essays in the History of Mechanics. Springer, Berlin Heidelberg New York 1968, S. 292–299.
- ↑ James Clerk Maxwell: On Boltzmann’s theorem on the average distribution of energy in a system of material points. In: William Davidson Niven (Hrsg.): The Scientific Papers of James Clerk Maxwell. Band 2. Dover, New York 1965, S. 713–741.
- ↑ Heinrich Friedrich Weber: Die specifischen Wärmen der Elemente Kohlenstoff, Bor und Silicium. In: Annalen der Physik. Band 230, Nr. 3, 1875, S. 367–423.
- ↑ Arnold Eucken: Die Molekularwärme des Wasserstoffs bei tiefen Temperaturen. In: Sitzungsberichte der Deutschen Akademie der Wissenschaften zu Berlin. Band 1912, Nr. 1, 1912, S. 141–151.
- ↑ Albert Einstein: Quantentheorie des einatomigen idealen Gases. In: Sitzungsberichte der preußischen Akademie der Wissenschaften. 1924.
Literatur
- Schwabl: Statistische Mechanik. Springer-Verlag, Berlin, 3. Auflage 2006, ISBN 978-3-540-31095-2.
Auf dieser Seite verwendete Medien
Autor/Urheber: Nick B., Lizenz: CC BY-SA 4.0
Die molare Wärmekapazität (molar heat capacity) bei 25°C dargestellt für die meisten Elemente als Funktion der Ordnungszahl (atomic number). Die gezeigten Werte für Brom und Iod gelten für den Gaszustand. Die Elemente Bor B, Kohlenstoff C und Silizium Si haben eine sehr kleine Wärmekapazität und sind hellblau herausgehoben.
