Phasendiagramme
Relevante Bilder































Relevante Artikel
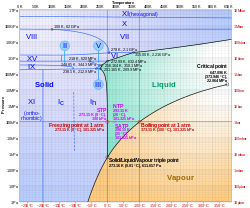
PhasendiagrammEin Phasendiagramm ist eine Projektion von Phasengrenzlinien aus dem Zustandsraum eines thermodynamischen Systems in ein zweidimensionales kartesisches Koordinatensystem oder in ein Dreiecksdiagramm. Neben Phasengrenzlinien können Phasendiagramme auch Spinodalen enthalten. Phasendiagramme sind ein häufig genutztes Hilfsmittel in der Chemie, den Materialwissenschaften, der Physik und der Verfahrenstechnik, um das Phasenverhalten von Reinstoffen und Stoffgemischen graphisch darzustellen. Mögliche sich einstellende „metastabile Zustände“ werden in einem Phasendiagramm nicht berücksichtigt. .. weiterlesen
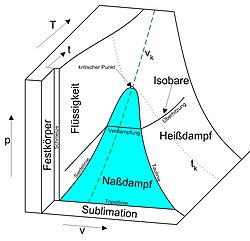
P-T-DiagrammEin p-T-Diagramm ist die am weitesten verbreitete Form eines Phasendiagramms, bei der der Druck p eines Systems gegen die Temperatur T aufgetragen wird. .. weiterlesen
Sublimationsdruck (Physik)Der Sublimationsdruck ist der Druck, unter dem die Gasphase eines festen Stoffes steht, wenn Festkörper und Gas im thermodynamischen Gleichgewicht vorliegen. Dabei wird das Gas aus dem Festkörper durch Sublimation oder umgekehrt der Festkörper aus dem Gas durch Resublimation gebildet. Es ist zu beachten, dass der Stoff direkt in die Gasphase sublimiert oder sich umgekehrt aus der Gasphase verfestigt, ohne die flüssige Phase zu durchlaufen. Druck und Temperatur müssen dazu unterhalb des Tripelpunktes liegen, also auf der Phasengrenzlinie zwischen Gas und Feststoff, der sogenannten Sublimationsdruckkurve eines Phasendiagramms. Da diese nur einen Freiheitsgrad besitzt, sind Sublimationsdruck und Sublimationstemperatur voneinander abhängig, was die Clapeyron-Gleichung zum Ausdruck bringt. Der übergeordnete Begriff Sättigungsdampfdruck umfasst den Sublimationsdruck (fest/gasförmig) und den Siededruck (flüssig/gasförmig). .. weiterlesen
ResublimierenAls Resublimieren werden verschiedene Vorgänge bezeichnet:In der Thermodynamik das unmittelbare Übergehen eines Stoffes vom gasförmigen in den festen Aggregatzustand (Phasenübergang). Die Phasenumwandlung in Gegenrichtung bezeichnet man als Sublimation. Eine Methode der Stoffreinigung und der Stofftrennung, bei der ein Sublimationsvorgang mehrfach nacheinander durchgeführt wird. .. weiterlesen
GefrierpunktAls Gefrierpunkt, Erstarrungspunkt oder Festpunkt werden jene Punkte in einem Phasendiagramm bezeichnet, die an der Grenze zwischen den Aggregatzuständen „fest“ und „flüssig“ liegen. Der allgemein bekannteste Gefrierpunkt ist der von Wasser. Auf der in Grad Celsius unterteilten Temperaturskala bildet beziehungsweise definiert er den Nullpunkt. Wenn jemand ohne nähere Angaben vom „Gefrierpunkt“ spricht, meint er in der Regel den von reinstem Wasser, also 0 °C. .. weiterlesen
SiedepunktDer Siedepunkt, Verdampfungspunkt oder auch Kochpunkt eines Reinstoffes ist ein Wertepaar in dessen Phasendiagramm und besteht aus zwei Größen: der Sättigungstemperatur und dem Sättigungsdampfdruck an der Phasengrenzlinie zwischen Gas und Flüssigkeit. Er setzt sich also aus den beiden Zustandsgrößen Druck und Temperatur beim Übergang eines Stoffes vom flüssigen in den gasförmigen Aggregatzustand zusammen. Bei einer offenen Flüssigkeit ist der Siedepunkt daher der Punkt auf der Temperaturskala, bei der der Dampfdruck gleich dem atmosphärischen Druck ist. .. weiterlesen
TripelpunktIn der Thermodynamik ist ein Tripelpunkt ein Zustand eines aus einer einzigen Stoffkomponente bestehenden Systems, in dem Temperatur und Druck dreier Phasen im thermodynamischen Gleichgewicht stehen. .. weiterlesen
