Synthetischer molekularer Motor
Synthetische molekulare Motoren sind molekulare Maschinen, die in der Lage sind, unter Energiezufuhr zu rotieren. Obwohl der Begriff molekularer Motor ursprünglich ein natürlich vorkommendes Protein meinte, das (via Proteindynamik) Bewegung erzeugt, verwenden manche Arbeitsgruppen den Begriff, um nicht-biologische synthetische Motoren zu bezeichnen. Viele Chemiker verfolgen die Synthese solcher Motoren.[1] Die Idee des synthetischen molekularen Motors wurde erstmals von Richard Feynman 1959 in seiner Rede There’s Plenty of Room at the Bottom (englisch für "Unten ist eine Menge Platz") erwähnt.
Die Grundvoraussetzungen für einen synthetischen Motor sind die wiederholte 360-Grad-Bewegung, der Energieverbrauch und die gerichtete Drehbewegung. Die ersten Erfolge auf dem Gebiet waren der chemische Motor von T. Ross Kelly et al., der aber nur eine nicht-wiederholbare Drehung um 120 Grad ausführte, und der lichtbetriebene Motor von Ben Feringa et al., die 1999 in derselben Ausgabe von Nature erschienen. Ben Feringa erhielt für diese Entwicklung 2016 den Nobelpreis für Chemie. Im Jahre 2008 schlugen Petr Král und Mitarbeiter einen Elektronen-Tunnel-Motor vor, der kontinuierlich rotiert, und eröffneten so die Möglichkeit der praktischen Realisierung einer molekularen Maschine. Es ist zu erwarten, dass die Zahl der Berichte über Erfolge auf dem Gebiet steigen wird, sobald sich das Verständnis der Chemie und der Physik im Nanobereich verbessert.
Natürlich vorkommende molekulare Motoren finden sich zum Beispiel in Muskeln (Motorproteine) und beim Flagellum von Bakterien.
Chemisch angetriebene Rotationsmotoren
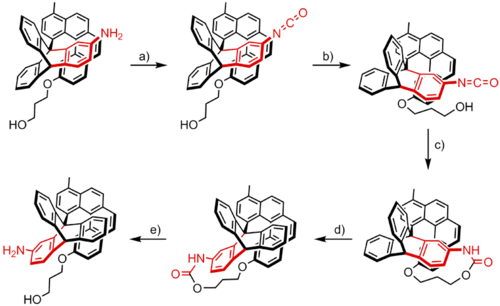
Ein Beispiel für einen chemisch betriebenen Rotationsmotor wurde von Kelly et al. 1999 beschrieben.[2] Das System wurde konstruiert aus einem Triptycen und einem Helicen und ist in der Lage, eine gerichtete Rotation durchzuführen. Die Rotation findet in fünf Schritten statt:
Die Amin-Gruppe der Tritycenverbindung wird durch eine Isocyanatgruppe substituiert durch Kondensation mit Phosgen (a). Thermale oder spontane Rotation um die zentrale Bindung bringt die Isocyanatgruppe in die Nähe der Hydroxygruppe, die sich in der Helicenhälfte befindet (b), wobei sie diesen beiden Gruppen ermöglicht, miteinander zu reagieren (c). Diese irreversible Reaktion formt das System zu einer Kette, einem cyclischen Carbamat, das energiereicher und damit näher an der Rotationsenergiebarriere ist als der ursprüngliche Zustand. Weitere Reaktion der Triptycenhälfte erfordert daher weniger Aktivierungsenergie, um die Energiebarriere zu überwinden, wobei die Kette (d) entsteht. Schließlich setzt die Spaltung der Urethangruppe die Amin- und die Alkohol-Gruppe des Moleküls frei (e). Das Ergebnis dieser Reaktionssequenz ist eine gerichtete 120°-Drehung des Triptycens relativ zur Heliceneinheit. Zusätzliche Vorwärts- und Rückwärtsdrehung des Triptycens wird verhindert durch die Helicenhälfte, deren Funktion die des Paddels einer Ratsche ist. Die gerichtete Bewegung des Systems ist das Resultat der asymmetrischen Anordnung der Helicenverbindung, ebenso wie die Kette des Urethansubstituenten, die in c gebildet wird. Die Kette kann nur gelockert werden durch die Drehung des Triptycenmoleküls im Uhrzeigersinn d, denn sowohl die Drehung gegen den Uhrzeigersinn als auch die Rückreaktion sind energetisch ungünstig. Von dem Standpunkt her ist die Bevorzugung einer Drehrichtung bestimmt durch die Anordnung der funktionellen Gruppen und der Form der Heliceneinheit und so abhängig vom Design des Moleküls und nicht von äußeren Faktoren.
Der Motor von Kelly et al. ist ein elegantes Beispiel, wie chemische Energie genutzt werden kann, um eine gerichtete Drehbewegung zu erzeugen, ein Prozess, der dem Verbrauch von Adenosintriphosphat in lebenden Organismen ähnelt, um zahlreiche Prozesse durchzuführen. Es gibt jedoch einen Nachteil: Die Reaktionsfolge, die zu einer Drehbewegung um 120° führt, ist nicht wiederholbar. Kelly et al. haben daher nach Wegen gesucht, das System so zu erweitern, dass diese Reaktionsfolge wiederholbar wird. Sie waren damit aber nicht erfolgreich und haben das Projekt aufgegeben.[3] Zwei weitere Beispiele für synthetische, chemisch betriebene molekulare Rotationsmotoren wurden in der Literatur beschrieben, die eine stereoselektive Ringöffnungsreaktion eines racemischen Biaryllactons mit Hilfe von chiralen Reagenzien nutzen, um eine gerichtete 90°-Drehung eines Aryls relativ zum anderen Aryl zu erzeugen. Branchud et al. publizierten diesen Versuch, der, gefolgt von einer Ringschlussreaktion, eine einfache 180°-Drehung ausführen kann.[4] Feringa et al. nutzten diesen Versuch, um eine Molekülstruktur zu entwickeln, die eine 360°-Drehung ausführt.[5] Die ganze Drehung dieses molekularen Motors vollzieht sich in vier Schritten. In den Zuständen A und C ist die Drehung des Aryls sterisch gehindert, obwohl die helicale Umkehrung möglich ist. In den Zuständen B und D kann das Aryl relativ zum Naphthalin drehen, wobei sterische Effekte das Aryl hindern, am Naphthalin vorbeizudrehen. Schritte 1 und 3 sind asymmetrische Ringöffnungsreaktionen, die ein chirales Reagenz nutzen, um die Drehrichtung des Aryls zu kontrollieren. Schritte 2 und 4 bestehen aus der Abspaltung der Schutzgruppe des Phenols, gefolgt von einer regioselektiven Ringschlussreaktion. Bislang ist dieser molekulare Motor das einzige Beispiel eines chemisch betriebenen Rotationsmotors, der eine 360°-Drehung ausführen kann.
Lichtbetriebene molekulare Rotationsmotoren

1999 wurde im Labor von B.L.Feringa, Universität Groningen, Niederlande, über die Entwicklung eines molekularen Motors berichtet.[6] Der um 360° drehbare molekulare Motor besteht aus einem bis-Helicen, verbunden über eine Alken-Doppelbindung, das axiale Chiralität zeigt und zwei Stereozentren besitzt. Der Kreislauf der gerichteten Rotation verläuft in vier Schritten. Der erste Schritt ist eine Tieftemperatur-endotherme Photoisomerisierung des trans-P,P-Isomers l zum cis-M,M-Isomer 2, wobei P für rechtsdrehende Helix und M für die linksdrehende Helix steht. In diesem Reaktionsverlauf werden die zwei axialen Methylgruppen in zwei sterisch weniger günstige, aequatorial gebundene Methylgruppen umgewandelt. Bei Erhitzen auf 20 °C verschieben sich diese Methylgruppen der Struktur (P,P) in einer exothermen Reaktion, der Helixinversion, zurück in die axiale cis-Konformation 3. Da das axiale Isomer stabiler ist als das aequatoriale Isomer, ist die Rückreaktion blockiert. Eine zweite Photoisomerisierung verwandelt die P,P-cis-Struktur 3 in die trans-Struktur 4, wiederum unter Bildung der sterisch ungünstigeren aequatorialen Position. Eine thermale Isomerisierung bei 60 °C schließt den 360°-Kreislauf unter Rückverschiebung der Methylgruppen in die axiale Position.

Eine größere Hürde ist die lange Reaktionszeit, mit der die Systeme eine komplette Drehung durchführen, was nicht vergleichbar ist mit der Geschwindigkeit, mit der Motorproteine in biologischen Systemen rotieren. Im schnellsten System, mit Fluoren in der unteren Hälfte, liegt die Halbwertszeit für die thermale Helixinversion bei 0,005 Sekunden.[7] Diese Verbindung wird in einer Barton-Kellog-Reaktion synthetisiert. Bei diesem Molekül ist der langsamste Schritt der Drehung die thermale Helixinversion, die man eigentlich für schneller hielt, da das Isomer mit tert-butyl-Gruppe weniger stabil ist als mit der verwendeten Methylgruppe. Das instabile Isomer ist nämlich stärker destabilisiert als der Übergangszustand, der zur Helixinversion führt. Das unterschiedliche Verhalten der beiden Isomere wird veranschaulicht durch die Tatsache, dass die Halbwertszeit für die Verbindung mit der Methylgruppe an Stelle der tert-Butylgruppe bei 3,2 Minuten liegt.[8]
Feringas Prinzip wurde verwendet für den Prototyp eines Nanoautos.[9] Das synthetierte Auto hat eine Helicen-betriebene Maschine mit einer oligo-Phenylethinylen-Karosserie und vier Carboran-Rädern und man erwartet, dass sie in der Lage ist, sich auf einer Feststoffoberfläche zu bewegen, was im Rastertunnelmikroskop beobachtbar sein soll, was aber bisher noch nicht geschehen ist. Der Motor funktioniert nicht mit Fulleren-Rädern, weil diese die Photochemie des Motors löschen würden. Es wurde gezeigt, dass Feringa-Motoren funktionsfähig bleiben, wenn sie chemisch an Feststoffoberflächen gebunden werden.[10][11] Die Möglichkeit der Verwendung bestimmter Feringa-Systeme als asymmetrische Katalysatoren konnte nachgewiesen werden.[12][13]
Experimentelle Realisierung eines elektrischen Einzel-Molekül-Motors
Ein elektrischer Einzel-Molekül-Motor wurde beschrieben, der aus einem einzelnen Butyl-Dimethylsulfoxid-Molekül besteht. Dieses Molekül wird von einem Kupfer-Einkristall (111) durch Chemisorption absorbiert.[14]
Nanoskopische Beobachtung molekularer Rotation
Ein Rotor und ein Stator sind zwei erforderliche Komponenten, um eine Drehbewegung hervorzurufen. Ein Rotor-Stator-Paar kann hergestellt werden, indem man propellerförmige Supramoleküle an einem Nanokanal befestigt, der als Armatur mit gleichmäßigem Durchmesser dient. Eine Alternative zu kreisförmigen Statoren sind hexagonale Blätter, die aus Molekülen bestehen, die aus dem Bereich der zweidimensionalen molekularen Selbstassemblierung und der molekularen Nanotechnologie bekannt sind. Wenn man hexagonale Nanokanäle auf einem Silbersubstrat verwendet, kann man in Echtzeit molekulare Rotation beobachten, auf Metalloberflächen mit Rastertunnelmikroskopie analysieren und mit Molekülsimulationen veranschaulichen.[15]
Literatur
- T. Ross Kelly: Molecular Machines (= Topics in Current Chemistry. Band 262). Springer Science & Business Media, 2005, ISBN 3-540-28501-6, doi:10.1007/b105501.
- Miriam R. Wilson, Jordi Solà, Armando Carlone, Stephen M. Goldup, Nathalie Lebrasseur, David A. Leigh: An autonomous chemically fuelled small-molecule motor. In: Nature. Band 534, Nr. 7606, Juni 2016, S. 235–240, doi:10.1038/nature18013.
- Salma Kassem, Thomas van Leeuwen, Anouk S. Lubbe, Miriam R. Wilson, Ben L. Feringa, David A. Leigh: Artificial molecular motors. In: Chemical Society Reviews. Band 46, Nr. 9, 2017, S. 2592–2621, doi:10.1039/C7CS00245A.
- Anna-Katharina Pumm u. a.: A DNA origami rotary ratchet motor. In: Nature. Band 607, Nr. 7919, Juli 2022, S. 492–498, doi:10.1038/s41586-022-04910-y.
Einzelnachweise
- ↑ Jordan R. Quinn:Synthetic Molecular Motors ( vom 16. August 2011 im Internet Archive) scs.uiuc.edu, 2002, abgerufen am 18. November 2015.
- ↑ T. R. Kelly, H De Silva, R. A. Silva: Unidirectional rotary motion in a molecular system. In: Nature. 401. Jahrgang, Nr. 6749, 1999, S. 150–2, doi:10.1038/43639.
- ↑ T. Ross Kelly, Xiaolu Cai, Fehmi Damkaci, Sreeletha B. Panicker, Bin Tu, Simon M. Bushell, Ivan Cornella, Matthew J. Piggott, Richard Salives, Marta Cavero, Yajun Zhao, Serge Jasmin: Progress toward a Rationally Designed, Chemically Powered Rotary Molecular Motor. In: Journal of the American Chemical Society. 129. Jahrgang, Nr. 2, 2007, S. 376, doi:10.1021/ja066044a, PMID 17212418.
- ↑ Ying Lin, Bart J. Dahl, Bruce P. Branchaud: Net directed 180° aryl–aryl bond rotation in a prototypical achiral biaryl lactone synthetic molecular motor. In: Tetrahedron Letters. 46. Jahrgang, Nr. 48, 2005, S. 8359, doi:10.1016/j.tetlet.2005.09.151.
- ↑ S. P. Fletcher, F Dumur, MM Pollard, BL Feringa: A Reversible, Unidirectional Molecular Rotary Motor Driven by Chemical Energy. In: Science. 310. Jahrgang, Nr. 5745, 2005, S. 80–2, doi:10.1126/science.1117090, PMID 16210531.
- ↑ Ben L. Feringa, Nagatoshi Koumura, Robert W. J. Zijlstra, Richard A. Van Delden, Nobuyuki Harada: Light-driven monodirectional molecular rotor. In: Nature. 401. Jahrgang, Nr. 6749, 1999, S. 152, doi:10.1038/43646, PMID 10490022.
- ↑ Javier Vicario, Martin Walko, Auke Meetsma, Ben L. Feringa: Fine Tuning of the Rotary Motion by Structural Modification in Light-Driven Unidirectional Molecular Motors. In: Journal of the American Chemical Society. 128. Jahrgang, Nr. 15, 2006, S. 5127, doi:10.1021/ja058303m, PMID 16608348.
- ↑ Javier Vicario, Auke Meetsma, Ben L. Feringa: Controlling the speed of rotation in molecular motors. Dramatic acceleration of the rotary motion by structural modification. In: Chemical Communications. Nr. 47, 2005, S. 5910, doi:10.1039/b507264f.
- ↑ Jean-François Morin, Yasuhiro Shirai, James M. Tour: En Route to a Motorized Nanocar. In: Organic Letters. 8. Jahrgang, Nr. 8, 2006, S. 1713, doi:10.1021/ol060445d, PMID 16597148.
- ↑ Gregory T. Carroll, Michael M. Pollard, Richard Van Delden, Ben L. Feringa: Controlled rotary motion of light-driven molecular motors assembled on a gold film. In: Chemical Science. 1. Jahrgang, 2010, S. 97, doi:10.1039/C0SC00162G.
- ↑ Gregory T. Carroll, Gábor London, Tatiana Fernández Landaluce, Petra Rudolf, Ben L. Feringa: Adhesion of photon-driven molecular motors to surfaces via 1, 3-dipolar cycloadditions: Effect of interfacial interactions on molecular motion. In: ACS Nano. 5. Jahrgang, Nr. 1, 2011, S. 622–30, doi:10.1021/nn102876j, PMID 21207983.
- ↑ J. Wang, B. L. Feringa: Dynamic Control of Chiral Space in a Catalytic Asymmetric Reaction Using a Molecular Motor Science. In: Science. 331. Jahrgang, Nr. 6023, 2011, S. 1429, doi:10.1126/science.1199844, PMID 21310964.
- ↑ T. Ooi: Heat and Light Switch a Chiral Catalyst and Its Products. In: Science. 331. Jahrgang, Nr. 6023, 2011, S. 1395–1396, doi:10.1126/science.1203272, PMID 21415343.
- ↑ Heather L. Tierney u. a.: Experimental demonstration of a single-molecule electric motor. In: Nature Nanotechnology. Band 6, Nr. 10, Oktober 2011, S. 625–629, doi:10.1038/nnano.2011.142.
- ↑ D. Kuhne, F. Klappenberger, W. Krenner, S. Klyatskaya, M. Ruben, J. V. Barth: Rotational and constitutional dynamics of caged supramolecules. In: Proceedings of the National Academy of Sciences. 107. Jahrgang, Nr. 50, 2010, S. 21332, doi:10.1073/pnas.1008991107.
Auf dieser Seite verwendete Medien
Synthetic molecular motors: fluorene system.
Chemically driven rotary molecular motor, Feringa 2005
Chemically driven rotary molecular motor, Kelly 1999
Scanning tunneling microscopy ~100 second movie of rotation of a supramolecule composed of three molecules using a, in a confined nanoscopic pore (outer diameter = 6.7 nm) on a silver surface at ~ 80 K.
Molecular dynamics ~1 nanosecond movie of rotation of a supramolecule composed of three molecules using a, in a confined nanoscopic pore (outer diameter = 6.7 nm) on a silver surface at ~ 250 K.
Rotary cycle of the first-generation light-driven rotary molecular motor, Feringa 1999







