Photokatalyse
Das Phänomen der Photokatalyse (standardsprachlich Fotokatalyse) beschreibt nach Plotnikow jede durch Licht ausgelöste chemische Reaktion. Balzani bezeichnet kinetisch gehemmte exergonische Reaktionen zwischen zwei Partnern A und B, die durch Lichtanregung induziert werden, als Photokatalyse.
Wilhelm Ostwald dagegen stellt die folgende klassische und noch heute gültige Definition der Katalyse auf:[1]
„Endlich gibt es zahlreiche Stoffe, deren Zusatz bereits bei sehr geringen Mengen die Geschwindigkeit einer chemischen Reaktion ändert. In der Mehrzahl der Fälle beteiligen sich diese Stoffe insofern nicht am chemischen Vorgang, als man sie während desselben und auch nach demselben in praktisch unveränderter Menge wiederfindet. Das schließt allerdings nicht aus, dass sie sich an der Reaktion beteiligen, sondern erfordert nur die Annahme, dass die Beteiligung vorübergehend ist, d. h. dass sich diese Stoffe (…) aus den Reaktionsprodukten wieder in unverändertem Zustand freimachen.“
Dies lässt ein Problem erkennen: Photonen selbst können nicht als Katalysator betrachtet werden, da sie während der Reaktion verbraucht werden und nicht in „unverändertem Zustand“ wieder zur Verfügung stehen. Allerdings ist eine Vielzahl von Reaktionen bekannt, die bei Raumtemperatur nur mäßig oder gar nicht ablaufen, bei Lichteinstrahlung jedoch beträchtlich beschleunigt werden. Als Beispiel hierfür sei die Photosynthese der Pflanzen genannt, bei der die vom Sonnenlicht aufgenommene photonische Energie übertragen wird auf die katalytische Reaktion von Kohlendioxid und Wasser zu Kohlenhydraten und Sauerstoff.
In der modernen Literatur werden die photokatalytischen Reaktionen in zwei Kategorien unterteilt:
- die katalytische Photoreaktion und die
- photosensibilisierte Katalyse, wobei letztere unterschieden wird in eine
- photoinduzierte katalytische Reaktion und eine
- photoassistierte katalytische Reaktion.
Katalytische Photoreaktion
Ein photoaktiviertes Molekül tritt mit einem Katalysator in Wechselwirkung, der sich im elektronischen Grundzustand befindet. Ohne eine photochemische Anregung des Substrats (A) findet trotz Anwesenheit des Katalysators keine Reaktion statt (linke Seite). Erst nach erfolgter photochemischer Anregung des Substrats (A') wird durch den Katalysator (K) die Reaktion katalysiert.
Photosensibilisierte Katalyse
Der Katalysator wird direkt in einen elektronisch angeregten Zustand überführt. Dem Katalysator wird dabei die gleiche Wirkung wie bei der klassischen Katalyse nach Wilhelm Ostwald zugesprochen, jedoch sind zur Beschreibung der Reaktionsverläufe die speziellen Eigenschaften elektronisch angeregter Spezies zu berücksichtigen.
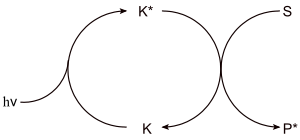
Photoinduzierte katalytische Reaktion
Einmalig photochemisch angeregter Katalysator (K*) bewirkt katalytische Substratumwandlung (S) zu einem Übergangszustand (P*) mit dessen Hilfe erneut ein Katalysator-Molekül angeregt wird.
Beispiel fotografischer Prozess: der Katalysator, metallisches Silber, wird bei der Belichtung nach oben stehendem Prinzip erzeugt und katalysiert dann die Reduktion von weiterem Silberbromid bei gleichzeitiger Oxidation des Entwicklers.
Photoassistierte katalytische Reaktion
Die photoassistierte katalytische Reaktion erfordert eine permanente Einwirkung von Licht geeigneter Wellenlänge zur Erzeugung des angeregten Katalysator-Zustands (K*). Wird die Lichtstrahlung unterbunden, setzt auch die Reaktion aus.
Als Katalysator wird häufig Anatas, eine Modifikation von Titandioxid eingesetzt. Eine photoassistierte katalytische Reaktion setzt sich aus einer Reihe von physikalischen und chemischen Prozessen ab. Am Anfang steht die Absorption des Lichts. Dabei werden Elektronen in Zustände mit höherer Energie angeregt, bei einem Halbleiter wie Titandioxid von Zuständen des Valenzbands in Zustände des Leitungsbandes (siehe auch Bändermodell). Dies ist gleichbedeutend mit der Bildung eines Elektron-Loch-Paares. Der nächste Schritt ist die räumliche Trennung von Elektron und Loch und ihre Diffusion an die Oberfläche des Halbleiters. Dort löst dann das Elektron eine Reduktion und das Loch eine Oxidation aus (z. B. kann aus einem Hydroxid-Ion (OH−) ein sehr reaktives Radikal (OH.) gebildet werden). Oft schließen sich weitere chemische Folgereaktionen an.
Anwendungen
- Photokatalytische Wasserspaltung
- Biokatalytische Abwasserreinigung
- Photovoltaik
- Photokatalytische Selbstreinigung von Außenfassaden
- Photokatalytische Luftreinigung
- künstliche anorganischen Photosynthese
- Photodynamische Therapie
Literatur
- V. Parmon, A.V. Emeline, N. Serpone: IUPAC Glossary of Terms in Photocatalysis and Radiocatalysis (PDF; 299 kB).
- N. Serpone, A. V. Emeline: Suggested terms and definitions in photocatalysis and radiocatalysis. In: International Journal of Photoenergy. 4, 2002, doi:10.1155/S1110662X02000144, S. 91–141, (englisch)
Weblinks
- Nachweisverfahren
- Artikel „Putzen mit der Kraft des Lichts“ von Susanne Donner
- Allianz Photokatalyse
- Abwasserbehandlung mit Licht, Luft und Farbstoff
- Fachverband angewandte Photokatalyse
Belege
- ↑ Wilhelm Ostwald: Prinzipien der Chemie. Eine Einleitung in alle chemischen Lehrbücher. BoD – Books on Demand, 2011, ISBN 3-86195-689-6, S. 461 (eingeschränkte Vorschau in der Google-Buchsuche).
Auf dieser Seite verwendete Medien
Katalytische Photoreaktion
Photoassistierte katalytische Reaktion
Photoinduzierte, katalytische Reaktion