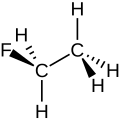
Fluorethan
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Darstellung in Skelettformel-Schreibweise | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Fluorethan | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C2H5F | |||||||||||||||
| Kurzbeschreibung | extrem entzündbares Gas[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 48,06 g·mol−1 | |||||||||||||||
| Aggregatzustand | gasförmig[1] | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | −37,1 °C[1] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit | wenig löslich in Wasser[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Treibhauspotential | 4 (bezogen auf 100 Jahre)[2] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Fluorethan ist eine chemische Verbindung aus der Gruppe der gesättigten Fluorkohlenwasserstoffe.
Gewinnung und Darstellung
Fluorethan kann durch Reaktion von Ethen mit Fluorwasserstoff oder durch Reaktion von Chlorethan mit Silber(I)-fluorid gewonnen werden.[3]
Eigenschaften
Fluorethan ist ein extrem entzündbares Gas, das wenig löslich in Wasser ist. Es zersetzt sich bei Erhitzung, wobei unter anderem Fluorwasserstoff entsteht. Seine kritische Temperatur liegt bei 102,3 °C, der kritische Druck bei 50,3 bar und die kritische Dichte bei 0,8176 g/cm3.[1]
Fluorethan bildet entzündliche Dampf-Luft-Gemische. Der Explosionsbereich liegt zwischen 5 Vol.‑% (100 g/m3) als untere Explosionsgrenze (UEG) und 10 Vol.‑% (200 g/m3) als obere Explosionsgrenze (OEG).[1]
Das Fluorethan-Molekül kann mit unterschiedlichen Formelschreibweisen dargestellt werden:
Verwendung
Fluorethan kann als Kältemittel verwendet werden,[4] hat aber aufgrund seiner Eigenschaften praktisch keine industrielle Bedeutung.[5]
Sicherheitshinweise
Fluorethan bildet mit Luft ein explosionsfähiges Gemisch.[1]
Einzelnachweise
- ↑ a b c d e f g h i j k l m n Eintrag zu CAS-Nr. 353-36-6 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 28. Oktober 2019. (JavaScript erforderlich)
- ↑ G. Myhre, D. Shindell et al.: Climate Change 2013: The Physical Science Basis. Working Group I contribution to the IPCC Fifth Assessment Report. Hrsg.: Intergovernmental Panel on Climate Change. 2013, Chapter 8: Anthropogenic and Natural Radiative Forcing, S. 24–39; Table 8.SM.16 (ipcc.ch [PDF]).
- ↑ Dr. P. B. Saxena: I.I.T. Chemistry. 2008, S. O-218 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Jiangtao Wu, Yong Zhou: An Equation of State for Fluoroethane (R161). In: International Journal of Thermophysics. 33, 2012, S. 220–234, doi:10.1007/s10765-011-1151-3.
- ↑ Peter Fabian, Onkar N. Singh: Reactive Halogen Compounds in the Atmosphere. Springer, 1999, ISBN 3-540-64090-8, S. 87 (eingeschränkte Vorschau in der Google-Buchsuche).
Auf dieser Seite verwendete Medien
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for flammable substances
Fluoroethane structure
Keilstrichformel von Fluorethan.
Struktur von Fluorethan.
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for gases under pressure
Ball-and-stick model of the fluoroethane molecule (also known as ethyl fluoride), an organofluoride.