Creutz-Taube-Komplex
| Strukturformel | |||||||
|---|---|---|---|---|---|---|---|
 | |||||||
| Allgemeines | |||||||
| Name | Creutz-Taube-Komplex | ||||||
| Summenformel | C4H34N12Ru2 | ||||||
| Externe Identifikatoren/Datenbanken | |||||||
| |||||||
| Eigenschaften | |||||||
| Molare Masse | 452,14 g·mol−1 (Kation) | ||||||
| Sicherheitshinweise | |||||||
| |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||
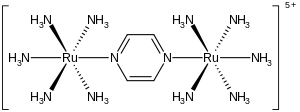
Der Creutz-Taube-Komplex ist ein Metallkomplex mit der Formel [Ru(NH3)5]2(C4H4N2)5+.
Der kationische Creutz-Taube-Komplex ist eine gemischtvalente Verbindung, die Metallionen in zwei verschiedenen Oxidationsstufen aufweist. Der Komplex wurde eingehend studiert, um die Effekte des Elektronentransfers nach dem Innensphärenmechanismus zwischen Metallzentren zu untersuchen.
Der Komplex ist benannt nach Carol Creutz, die als Erste den Komplex synthetisierte und ihrem Betreuer, Henry Taube, der für die Arbeiten um den intramolekularen Elektronentransfer mit dem Nobelpreis ausgezeichnet wurde.[2][3]
Eigenschaften
Der Komplex besteht aus zwei Rutheniumkernen, die von fünf Ammoniumliganden umgeben sind. Die Kerne sind über die Stickstoffatome eines zentralen, verbrückenden Pyrazinliganden verbunden. Das besondere an dem Komplex ist, dass die Rutheniumatome eine formale Ladung von 2,5+ aufweisen. Es wurde kristallographisch belegt, dass die beiden Metallzentren elektronisch äquivalent sind.[4][5]
Ein Charakteristikum gemischtvalenter Komplexe ist eine starke Absorption im nahen Infrarot. Der Creutz-Taube-Komplex weist ein Absorptionsmaximum bei 1570 nm auf.[6] Diese Absorption wird beschrieben als intervalente Charge-Transfer-Bande.
Synthese
Das Ion wurde erstmals als hydratisiertes Salz [Ru(NH3)5]2(C4H4N2)(O3SC6H4CH3)5.3H2O gewonnen.
Es wird in zwei Schritten aus dem Pyrazinkomplex [Ru(NH3)5(C4H4N2)]2+ hergestellt:[2]
Der Creutz-Taube-Komplex illustriert die Vorteile von Ruthenium-Komplexen für die Untersuchung von Redoxreaktionen. Ru(II)- und Ru(III)-Ionen können unter milden Bedingungen ineinander überführt werden. Die Komplexe mit Metallionen der einzelnen Oxidationsstufen sind kinetisch inert.
Weblinks
- Taube’s Nobelpreisvortrag (PDF; 811 kB)
Einzelnachweise
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b C. Creutz C. H. Taube: Direct Approach to Measuring the Franck-Condon Barrier to Electron Transfer Between Metal Ions. In: J. Am. Chem. Soc. 91, 1969, S. 3988–3989; doi:10.1021/ja01042a072.
- ↑ H. Taube, Electron Transfer between Metal Complexes. Nobelpreislesung, 8. Dezember 1983, (nobelprize.org PDF).
- ↑ U. Fürholz, S. Joss, H. B. Bürgi, A. Ludi: The Creutz-Taube Complex Revisited: Crystallographic Study of the Electron-Transfer Series (μ-pyrazine) decaamminediruthenium ([(NH3)5Ru(Pyz)Ru(NH3)5]n+ (n = 4–6)), in: Inorg. Chem. 24, 1985, S. 943–948, doi:10.1021/ic00200a028.
- ↑ D. Yokogawa, H. Sato, Y. Nakao, S. Sakaki: Localization or Delocalization in the Electronic Structure of Creutz-Taube-Type Complexes in Aqueous Solution, in: Inorg. Chem. 47, 2007, S. 1966–1974, doi:10.1021/ic060173a.
- ↑ J. R. Gispert: Coordination Chemistry, S. 424, 1. Auflage, Wiley-VCH, Weinheim, 2008, ISBN 3-527-31802-X.
Auf dieser Seite verwendete Medien
Struktur des Creutz-Taube Ions
