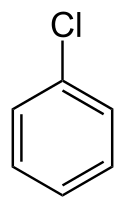
Chlorbenzol
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Chlorbenzol | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C6H5Cl | |||||||||||||||
| Kurzbeschreibung | farblose Flüssigkeit mit benzolartigem Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 112,56 g·mol−1 | |||||||||||||||
| Aggregatzustand | flüssig[1] | |||||||||||||||
| Dichte | 1,11 g·cm−3 (20 °C)[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | 132 °C[1] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
| |||||||||||||||
| Brechungsindex | 1,5241 (20 °C)[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK | ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Chlorbenzol (C6H5Cl, Monochlorbenzol) ist ein aromatischer Halogenkohlenwasserstoff. Das Molekül ist wie Benzol aufgebaut, eines der sechs Wasserstoff-Atome des Benzols ist durch ein Chlor-Atom substituiert.
Darstellung
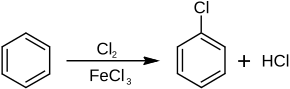
Chlorbenzol entsteht beim Chlorieren von Benzol mit Chlor in Gegenwart von Eisen oder Eisenchlorid.[6] Dabei entsteht auch das Nebenprodukt 1,4-Dichlorbenzol.
Eigenschaften
Physikalische Eigenschaften
Chlorbenzol ist eine farblose Flüssigkeit, die unter Normaldruck bei 132 °C siedet.[1] Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in kPa, T in K) mit A = 4,11083, B = 1435,675 und C = −55,124 im Temperaturbereich von 335 K bis 405 K.[7]
Wichtige thermodynamische Größen werden in der folgenden Tabelle gegeben:
| Eigenschaft | Typ | Wert [Einheit] | Bemerkungen |
|---|---|---|---|
| Standardbildungsenthalpie | ΔfH0liquid ΔfH0gas | 11,5 kJ·mol−1[8] 54,42 kJ·mol−1[9] | als Flüssigkeit als Gas |
| Verbrennungsenthalpie | ΔcH0liquid | −3112,7 kJ·mol−1[9] | als Flüssigkeit |
| Wärmekapazität | cp | 152,1 J·mol−1·K−1 (25 °C)[10] 1,35 J·g−1·K−1 (25 °C) | als Flüssigkeit |
| Kritische Temperatur | Tc | 632,35 K[11] | |
| Kritischer Druck | pc | 45,191 bar[11] | |
| Kritische Dichte | ρc | 3,24 mol·l−1[11] | |
| Schmelzenthalpie | ΔfH | 9,55 kJ·mol−1[12] | beim Schmelzpunkt |
| Verdampfungsenthalpie | ΔVH | 35,19 kJ·mol−1[13] | beim Normaldrucksiedepunkt |
Sicherheitstechnische Kenngrößen
Chlorbenzol bildet leicht entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt bei 28 °C.[1] Der Explosionsbereich liegt zwischen 1,3 Vol.-% (60 g/m3) als untere Explosionsgrenze (UEG) und 11 Vol.-% (520 g/m3) als obere Explosionsgrenze (OEG).[1] Eine Korrelation der unteren Explosionsgrenze mit der Dampfdruckfunktion ergibt einen unteren Explosionspunkt von 24 °C.[1] Der maximale Explosionsdruck beträgt 6,6 bar.[1] Die Zündtemperatur liegt bei 590 °C.[1] Der Stoff fällt somit in die Temperaturklasse T1.
Verwendung
Chlorbenzol wird als Lösungsmittel verwendet für Öle, Fette, Harze, Kautschuk, Ethylcellulose und Phenolharze. Es dient auch als Wärmeübertragungsmittel sowie als Edukt bei der Produktion von bestimmten Silikonen (Phenylsiloxanen). Bei der Herstellung von Insektiziden, Farbstoffen, Arzneimitteln und Duftstoffen entsteht es als Zwischenprodukt. In den USA dient es zur Herstellung von Schleifscheiben. In Deutschland wird für diesen Zweck Naphthalin verwendet.
Umwelt und Toxikologie
Chlorbenzol ist, wie die meisten halogenierten Aromaten, biologisch schwer abbaubar. Es reichert sich in der Natur in Gewässersedimenten an und wird über das Trinkwasser von Mensch und Tier aufgenommen. Im tierischen Gewebe wird es in Fettgewebe und Leber angesammelt. Es wirkt lähmend, indem es das Nervengewebe angreift. Die Schädigung von Föten ist möglich. Auch wirkt es stark hautreizend. Die Dämpfe wirken betäubend und sind nervenschädlich. Der Arbeitsplatzgrenzwert nach TRGS 900 beträgt 10 ml·m−3 bzw. 47 mg·m−3.[1]
Das leicht nachweisbare Chlorbenzol wird in der Umwelttechnik als Indikatorsubstanz für die Anwesenheit der wesentlich giftigeren und schwerer nachweisbaren Dioxine verwendet.
Neue Verfahren zum Abbau des Chlorbenzols in der Umwelt nutzen die Fähigkeit von Mikroorganismen, halogenierte Aromaten bei Anwesenheit von überschüssigem Luftsauerstoff zersetzen zu können, indem in belastete Gebiete (Böden, Gewässer) Luft eingeblasen wird.
Chlorbenzol wurde 2023 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von Chlorbenzol waren die Besorgnisse bezüglich Exposition von Arbeitnehmern, hoher (aggregierter) Tonnage und weit verbreiteter Verwendung sowie der möglichen Gefahren durch mutagene und reproduktionstoxische Eigenschaften sowie als potentieller endokriner Disruptor. Die Neubewertung läuft seit 2023 und wird von den Niederlanden durchgeführt.[14]
Weblinks
Einzelnachweise
- ↑ a b c d e f g h i j k l m n o p q r Eintrag zu Chlorbenzol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- ↑ Eintrag zu Chlorbenzol. In: Römpp Online. Georg Thieme Verlag, abgerufen am 22. Mai 2014.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-92.
- ↑ Eintrag zu Chlorobenzene im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 108-90-7 bzw. Chlorbenzol), abgerufen am 2. November 2015.
- ↑ Bertram Philipp, Peter Stevens: Grundzüge der Industriellen Chemie. VCH Verlagsgesellschaft, Weinheim 1987, ISBN 3-527-25991-0, S. 176.
- ↑ I. Brown: Liquid-Vapour Equilibria. III. The Systems Benzene-n-Heptane, n-Hexane-Chlorobenzene, and Cyclohexane-Nitrobenzene. In: Aust. J. Sci. Res. Ser. A. 5, 1952, S. 530–540.
- ↑ V. P. Kolesov, E. M. Tomareva, S. M. Skuratov, S. P. Alekhin: Calorimeter having a rotating bomb for determining heats of combustion of chlorinated organic compounds. In: Russ. J. Phys. Chem. (Engl. Transl.) 41, 1967, S. 817–820.
- ↑ a b V. A. Platonov, Yu. N. Simulin: Determination of the standard enthalpies of formation of polychlorobenzenes. III. The standard enthalpies of formation of mono-1,2,4- and 1,3,5-tri-, and 1,2,3,4- and 1,2,3,5-tetrachlorobenzenes. In: Russ. J. Phys. Chem. (Engl. Transl.) 59, 1985, S. 179–181.
- ↑ I. Shehatta: Heat capacity at constant pressure of some halogen compounds. In: Thermochim. Acta. 213, 1993, S. 1–10. doi:10.1016/0040-6031(93)80001-Q
- ↑ a b c S. Young: The Internal Heat of Vaporization constants of thirty pure substances. In: Sci. Proc. R. Dublin Soc. 12, 1910, S. 374.
- ↑ Eugene S. Domalski, Elizabeth D. Hearing: Heat Capacities and Entropies of Organic Compounds in the Condensed Phase. Volume III. In: J. Phys. Chem. Ref. Data. 25, 1, 1996. doi:10.1063/1.555985
- ↑ V. Majer, V. Svoboda: Enthalpies of Vaporization of Organic Compounds: A Critical Review and Data Compilation. Blackwell Scientific Publications, Oxford 1985, S. 300.
- ↑ Community rolling action plan (CoRAP) der Europäischen Chemikalienagentur (ECHA): Chlorobenzene, abgerufen am 28. November 2023.
Auf dieser Seite verwendete Medien
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for flammable substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances
chlorination of benzene